Использование ингибиторов ферментов
Весьма широко применяются в настоящее время ингибиторы протеаз (контрикал, гордокс) при панкреатитах – состояниях, когда происходит активирование пищеварительных ферментов в протоках и клетках поджелудочной железы.
Ингибиторы холинэстеразы (физостигмин, прозерин) приводят к накоплению нейромедиатора ацетилхолина в синапсах и показаны при миастении, двигательных и чувствительных нарушениях при невритах, радикулитах, психогенной импотенции.
Препараты, содержащие ингибиторы моноаминоксидазы (наком, мадопар), повышают выработку нейромедиаторов катехоламинов в ЦНС при лечении паркинсонизма. Подавление активности моноаминооксидазы (разрушающей катехоламины) сохраняет нормальную передачу сигналов в нервной системе.
Ингибиторы ангиотензинпревращающего фермента (каптоприл, эналаприл и т.п.) используются как антигипертензивное средство и вызывают расширение периферических сосудов, уменьшение нагрузки на миокард, снижение артериального давления.
Аллопуринол – ингибитор ксантиноксидазы, фермента катаболизма пуринов, требуется для снижения образования мочевой кислоты и подавления развития гиперурикемии и подагры.
Ингибиторы гидроксиметилглутарил-SКоА-редуктазы (ловастатин, флувастатин, аторвастатин) применяются для снижения синтеза холестерола при атеросклерозе, заболеваниях сердечно-сосудистой системы, дислипопротеинемиях.
Ингибитор карбоангидразы (ацетазоламид) используется как мочегонное средство при лечении глаукомы, отеков, эпилепсии, алкалозах и горной болезни.
6. Регуляция действия ферментов: аллостерические механизмы, химическая (ковалентная) модификация. Белок-белковые взаимодействия. Примеры метаболических путей, регулируемых этими механизмами. Физиологическое значение регуляции действия ферментов.
В клетке постоянно происходит большое количество разнообразных химических реакций, которые формируют метаболические пути - последовательное превращение одних соединений в другие. Чтобы воздействовать на скорость протекания метаболического пути, достаточно регулировать количество или активность ферментов. Обычно в метаболических путях есть ключевые ферменты, благодаря которым происходит регуляция скорости всего пути. Эти ферменты называются регуляторными ферментами; они катализируют, как правило, начальные реакции метаболического пути, необратимые реакции, скорость-лимитирующие реакции (самые медленные) или реакции в месте переключения метаболического пути (точки ветвления).
Регуляция скорости ферментативных реакций осуществляется на 3 независимых уровнях:
1. изменением количества молекул фермента;
2.доступностью молекул субстрата и кофермента;
3.изменением каталитической активности молекулы фермента. Важнейшее значение в изменении скорости метаболических путей играет регуляция каталитической активности одного или нескольких ключевых ферментов данного метаболического пути. Это высокоэффективный и быстрый способ регуляции метаболизма.
Основные способы регуляции активности ферментов:
1. Доступность субстрата или кофермента. Здесь работает закон действия масс – фундаментальный закон химической кинетики: при постоянной температуре скорость химической реакции пропорциональна произведению концентрации реагирующих веществ. Или упрощенно – скорость, с которой вещества реагируют друг с другом, зависит от их концентрации. Таким образом, изменение количества хотя бы одного из субстратов прекращает или начинает реакцию. Например, для цикла трикарбоновых кислот (ЦТК) таким субстратом является оксалоацетат (щавелевоуксусная кислота). Наличие оксалоацетата "подталкивает" реакции цикла, что позволяет вовлекать в окисление молекулы ацетил-SКоА. Именно из-за недостатка оксалоацетата (относительного или абсолютного) развивается кетоацидоз (механизм развития) при голодании и инсулинзависимом сахарном диабете.
2. Компартментализация – это сосредоточение ферментов и их субстратов в одном компартменте (одной органелле) – в эндоплазматическом ретикулуме, митохондриях, лизосомах. Например, ферменты цикла трикарбоновых кислот (ЦТК) и β-окисления жирных кислот расположены в митохондриях, ферменты синтеза белка – в рибосомах.
3. Изменение количества фермента может происходить в результате увеличения или снижения его синтеза. Изменение скорости синтеза фермента обычно зависит от количества определенных гормонов или субстратов реакции, например: -исчезновение пищеварительных ферментов при длительном голодании и их появление в восстановительный период (в результате изменения секреции кишечных гормонов); -при беременности и после родов в молочной железе активно идет синтез фермента лактозосинтазы под воздействием лактотропного гормона;
-гормоны глюкокортикоиды стимулируют синтез ферментов глюконеогенеза, что обеспечивает стабильность концентрации глюкозы в крови и устойчивость ЦНС к стрессу;
4. Ограниченный (частичный) протеолиз проферментов подразумевает, что синтез некоторых ферментов осуществляется в виде более крупного предшественника и при поступлении в нужное место этот фермент активируется через отщепление от него одного или нескольких пептидных фрагментов. Подобный механизм защищает внутриклеточные структуры от повреждений. Примером служит активация протеолитических ферментов желудочно-кишечного тракта (трипсиноген, пепсиноген, прокарбоксипептидазы), факторов свертывания крови, лизосомальных ферментов (катепсины).
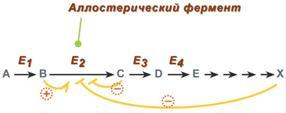 5. Аллостерическая регуляция. Аллостерические ферменты построены из двух и более субъединиц: одни субъединицы содержат каталитический центр, другие имеют аллостерический центр и являются регуляторными. Аллостерический центр (allos – чужой) – центр регуляции активности фермента, который пространственно отделен от активного центра и имеется не у всех ферментов. Связывание с аллостерическим центром какой-либо молекулы (называемой активатором или ингибитором, а также эффектором, модулятором, регулятором) вызывает изменение конфигурации белка-фермента и, как следствие, скорости ферментативной реакции. В качестве такого регулятора может выступать продукт данной или одной из последующих реакций, субстрат реакции или иное вещество. Присоединение эффектора к аллостерической (регуляторной) субъединице изменяет конформацию белка и, соответственно, активность каталитической субъединицы. Аллостерические ферменты обычно стоят в начале метаболических путей, и от их активности зависит течение многих последующих реакций. Поэтому они часто называются ключевыми ферментами. В качестве отрицательного регулятора может выступать конечный метаболит биохимического процесса или продукт данной реакции, т.е включается механизм обратной отрицательной связи. Если регуляторами являются начальный метаболит или субстрат реакции, то говорят о прямой регуляции, она может быть как положительной, так и отрицательной. Также регулятором могут быть метаболиты биохимических путей, каким-то образом связанных с данной реакцией. Например, фермент энергетического распада глюкозы, фосфофруктокиназа, регулируется промежуточными и конечными продуктами этого распада. При этом АТФ, лимонная кислота, фруктозо-1,6-дифосфат являются ингибиторами, а фруктозо-6-фосфат и АМФ – активаторами фермента. Аллостерическая регуляция имеет большое значение в следующих ситуациях:
5. Аллостерическая регуляция. Аллостерические ферменты построены из двух и более субъединиц: одни субъединицы содержат каталитический центр, другие имеют аллостерический центр и являются регуляторными. Аллостерический центр (allos – чужой) – центр регуляции активности фермента, который пространственно отделен от активного центра и имеется не у всех ферментов. Связывание с аллостерическим центром какой-либо молекулы (называемой активатором или ингибитором, а также эффектором, модулятором, регулятором) вызывает изменение конфигурации белка-фермента и, как следствие, скорости ферментативной реакции. В качестве такого регулятора может выступать продукт данной или одной из последующих реакций, субстрат реакции или иное вещество. Присоединение эффектора к аллостерической (регуляторной) субъединице изменяет конформацию белка и, соответственно, активность каталитической субъединицы. Аллостерические ферменты обычно стоят в начале метаболических путей, и от их активности зависит течение многих последующих реакций. Поэтому они часто называются ключевыми ферментами. В качестве отрицательного регулятора может выступать конечный метаболит биохимического процесса или продукт данной реакции, т.е включается механизм обратной отрицательной связи. Если регуляторами являются начальный метаболит или субстрат реакции, то говорят о прямой регуляции, она может быть как положительной, так и отрицательной. Также регулятором могут быть метаболиты биохимических путей, каким-то образом связанных с данной реакцией. Например, фермент энергетического распада глюкозы, фосфофруктокиназа, регулируется промежуточными и конечными продуктами этого распада. При этом АТФ, лимонная кислота, фруктозо-1,6-дифосфат являются ингибиторами, а фруктозо-6-фосфат и АМФ – активаторами фермента. Аллостерическая регуляция имеет большое значение в следующих ситуациях:
-при анаболических процессах. Ингибирование конечным продуктом метаболического пути и активация начальными метаболитами позволяют осуществлять регуляцию синтеза этих соединений;
-при катаболических процессах. В случае накопления АТФ в клетке происходит ингибирование метаболических путей, обеспечивающих синтез энергии. Субстраты при этом расходуются на реакции запасания резервных питательных веществ;
-для координации анаболических и катаболических путей. АТФ и АДФ - аллостерические эффекторы, действующие как антагонисты;
-для координации параллельно протекающих и взаимосвязанных метаболических путей (например, синтез пуриновых и пиримидиновых нуклеотидов, используемых для синтеза нуклеиновых кислот). Таким образом, конечные продукты одного метаболического пути могут быть аллостерическими эффекторами другого метаболического пути.
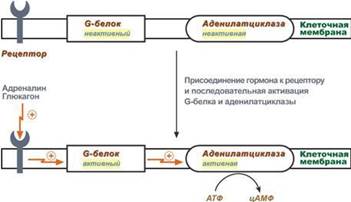 6. Белок-белковое взаимодействие обозначает ситуацию, когда в качестве регулятора выступают не метаболиты биохимических процессов, а специфичные белки. В целом ситуация схожа с аллостерическим механизмом: после влияния каких-либо факторов на специфичные белки изменяется активность этих белков, и они, в свою очередь, воздействуют на нужный фермент. К примеру, мембранный фермент аденилатциклаза является чувствительным к воздействию мембранного G-белка, который сам активируется при действии на клетку некоторых гормонов (например, адреналина и глюкагона).
6. Белок-белковое взаимодействие обозначает ситуацию, когда в качестве регулятора выступают не метаболиты биохимических процессов, а специфичные белки. В целом ситуация схожа с аллостерическим механизмом: после влияния каких-либо факторов на специфичные белки изменяется активность этих белков, и они, в свою очередь, воздействуют на нужный фермент. К примеру, мембранный фермент аденилатциклаза является чувствительным к воздействию мембранного G-белка, который сам активируется при действии на клетку некоторых гормонов (например, адреналина и глюкагона).
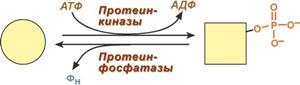 7. Ковалентная (химическая) модификация заключается в обратимом присоединении или отщеплении определенной группы, благодаря чему изменяется активность фермента. Чаще всего такой группой является фосфорная кислота, реже метильные и ацетильные группы. Фосфорилирование фермента происходит по остаткам серина и тирозина. Присоединение фосфорной кислоты к белку осуществляют ферменты протеинкиназы, отщепление – протеинфосфатазы. Ферменты могут быть активны как в фосфорилированном, так и в дефосфорилированном состоянии. Например, ферменты гликогенфосфорилаза и гликогенсинтаза при потребности организма в глюкозе фосфорилируются, при этом фосфорилаза гликогена становится активной и начинает расщепление гликогена, а гликогенсинтаза неактивна. При необходимости синтеза гликогена оба фермента дефосфорилируются, синтаза при этом становится активной, фосфорилаза – неактивной.
7. Ковалентная (химическая) модификация заключается в обратимом присоединении или отщеплении определенной группы, благодаря чему изменяется активность фермента. Чаще всего такой группой является фосфорная кислота, реже метильные и ацетильные группы. Фосфорилирование фермента происходит по остаткам серина и тирозина. Присоединение фосфорной кислоты к белку осуществляют ферменты протеинкиназы, отщепление – протеинфосфатазы. Ферменты могут быть активны как в фосфорилированном, так и в дефосфорилированном состоянии. Например, ферменты гликогенфосфорилаза и гликогенсинтаза при потребности организма в глюкозе фосфорилируются, при этом фосфорилаза гликогена становится активной и начинает расщепление гликогена, а гликогенсинтаза неактивна. При необходимости синтеза гликогена оба фермента дефосфорилируются, синтаза при этом становится активной, фосфорилаза – неактивной.
Активность ферментов в клетке непостоянна во времени. Ферменты чутко реагируют на ситуацию, в которой оказывается клетка, на факторы, воздействующие на нее как снаружи, так и изнутри. Главная цель такой чувствительности ферментов – отреагировать на изменение окружающей среды, приспособить клетку к новым условиям, дать должный ответ на гормональные и иные стимулы, а в некоторых ситуациях – получить шанс выжить.
7. Роль ферментов в метаболизме. Многообразие ферментов. Понятие о классификации. Наследственные первичные энзимопатии: фенилкетонурия, алкаптонурия. Другие примеры наследственных энзимопатий. Вторичные энзимопатии. Значение ферментов в медицине.
В клетке постоянно происходит большое количество разнообразных химических реакций, которые формируют метаболические пути - последовательное превращение одних соединений в другие. Метаболизм - совокупность всех метаболических путей, протекающих в клетках организма. Основу всех жизненных процессов составляют тысячи химических реакций, катализируемых ферментами.
В 1961 г в Москве V Международный биохимический союз принял современную классификацию ферментов. В соответствии с этой классификацией все ферменты делятся: а) на классы – по типу катализируемой реакции, б)каждый класс подразделяется на подклассы – по природе атакуемой химической группы, в) подклассы делятся на подподклассы – по характеру атакуемой связи или по природе акцептора. Выделяют 6 классов ферментов:
I класс – Оксидоредуктазы (Ферменты этого класса катализируют окислительно-восстановительные реакции, лежащие в основе биологического окисления. Класс насчитывает 22 подкласса. Коферментами этого класса являются НАД, НАДФ, ФАД, ФМН, убихинон, глутатион, липоевая кислота).
II класс – Трансферазы (Трансферазы катализируют реакции переноса различных групп от одного субстрата (донор) к другому (акцептор), участвуют в реакциях взаимопревращения различных веществ, обезвреживания природных и чужеродных соединений. Коферментами являются пиридоксальфосфат, коэнзим А, тетрагидрофолиевая кислота, метилкобаламин. Класс подразделяется на 9 подклассов в зависимости от строения переносимых групп. Примером подклассов являются ферменты, переносящие одноуглеродные фрагменты, альдегидные или кетоостатки, ацильные остатки, азотсодержащие группы, фосфорсодержащие группы. Часто встречается рабочее название трансфераз – киназы. Это трансферазы, катализирующие перенос фосфата от АТФ на субстрат (моносахариды, белки и др), т.е. фосфотрансферазы. Систематическое название образуется: Донор группы : акцептор группы – переносимая группа трансфераза).
III класс – Гидролазы (осуществляют разрыв внутримолекулярных связей в субстрате (за исключением С-С связей) путем присоединения элементов Н2О, подразделяются на 13 подклассов. Сохранены тривиальные названия, например, пепсин, трипсин. Коферменты отсутствуют. Широко представлены ферментами желудочно-кишечного тракта и лизосомальными ферментами. Осуществляют распад макромолекул, образуя легко адсорбируемые мономеры. Примером подклассов служат группы ферментов, действующие на сложные эфиры, на простые эфиры, на пептиды, на углерод-углеродные связи. Систематическое название образуется: Гидролизуемый субстрат : отделяемая группа гидролаза. Исторически названия гидролаз складывались из названия субстрата с окончанием "‑аза" – коллагеназа, амилаза, липаза, ДНК-аза. Наиболее часто встречаются следующие рабочие названия гидролаз: 1. Эстеразы – гидролиз сложноэфирных связей. 2. Липазы – гидролиз нейтральных жиров (триацилглицеролов). 3. Фосфатазы – гидролиз моноэфиров фосфорной кислоты. 4. Гликозидазы – гидролизуют О- и S-гликозидные связи. 5. Протеазы, пептидазы – гидролиз белков и пептидов. 6. Нуклеазы – гидролиз нуклеиновых кислот.).
IV класс – Лиазы (ферменты, катализирующие разрыв С-О, С-С, C-N и других связей, а также обратимые реакции отщепления различных групп негидролитическим путем. Выделяют 7 подклассов. Эти реакции сопровождаются образованием двойной связи или присоединением групп к месту двойной связи. Лиазы являются сложными ферментами. Коферментами служат пиридоксальфосфат, тиаминдифосфат, участвует магний, кобальт. Примером подклассов являются ферменты, действующие на углерод-углеродные связи, углерод-кислородные связи, углерод-азотные связи. Систематическое название образуется: Расщепляемый субстрат : отделяемая группа – лиаза).
V класс – Изомеразы (ферменты, катализирующие изомерные превращения в пределах одной молекулы. Изомеразы – сложные ферменты. К их коферментам относятся пиридоксальфосфат, дезоксиаденозилкобаламин, глутатион, фосфаты моносахаридов (глюкозо-1,6-дифосфат) и др. Выделяют 6 подклассов изомераз в зависимости от типа реакции. Например, в первый подкласс выделяют рацемазы (обратимое превращение L- и D-стереоизомеров) и эпимеразы (превращения изомеров, имеющих более одного центра асимметрии, например, α-D-глюкозу в β-D-глюкозу. Систематическое название образуется: Субстрат – [ ] – реакция, где [ ] – обозначение, отражающее суть реакции, например, "номер изменяемого атома углерода", изменение "цис-транс", изменение "кето-енол", изменение "альдозо-кетозо").
VI класс – Лигазы (синтетазы – ферменты, катализирующие присоединение друг к другу двух молекул с использованием энергии высокоэнергетических связей АТФ (или других макроэргов). Лигазы – сложные ферменты. Они содержат нуклеотидные (УТФ), биотиновые (витамин Н), фолиевые коферменты. Выделяют 6 подклассов. Примером подклассов служат группы ферментов по виду образуемой связи: углерод-кислород, углерод-сера, углерод-азот, углерод-углерод. Систематическое название образуется: Субстрат 1 : субстрат 2 – лигаза)
Каждому ферменту присвоен четырехзначный классификационный номер, включающий класс, подкласс, подподкласс и порядковый номер в подподклассе. Чтобы дать ферменту название существует два способа:
1. Систематическое название – согласно современной классификации. Часто такое название длинно и сложно для использования, поэтому как производное систематического названия у многих ферментов имеется одно или несколько рабочих названий. 2. Тривиальное название – название, сложившееся исторически. Например, пепсин, трипсин. Для некоторых ферментов (чаще для гидролаз) к названию субстрата добавляется окончание "-аза" – уреаза, амилаза, липаза. Тем не менее и у таких ферментов имеется систематическое название.
В случае, если фермент не может выполнять свою функцию, говорят об энзимопатологии (энзимопатии) – состояния, связанные с патологическим изменением активности ферментов. Наиболее часто встречается снижение активности и нарушение каких-либо метаболических процессов. В результате энзимопатологии клиническое значение может иметь:
-накопление субстрата реакции, например: фенилаланина при фенилкетонурии, свободного билирубина при желтухах новорожденных, некоторых жиров при болезнях лизосомального накопления (липидозы),
-недостаток продукта, например: меланина при альбинизме, катехоламинов при паркинсонизме,
-обе особенности одновременно, как при гликогенозах, сопровождающихся гипогликемией при избытке гликогена в печени.
По характеру нарушения выделяют первичные и вторичные энзимопатии.
Первичные (наследственные) энзимопатии связаны с генетическим дефектом и наследственным снижением активности. Например, фенилкетонурия связана с дефектом фенилаланин-4-монооксигеназы, которая превращает фенилаланин в тирозин. В результате накапливаются аномальные метаболиты фенилаланина, оказывающие сильный токсический эффект. Заболевание подагра связано с дефектом ферментов метаболизма пуриновых оснований и накоплением мочевой кислоты. Алкаптонурия - нарушено окисление гомогентизиновой кислоты в тканях (гомогентизиновая кислота - промежуточный метаболит катаболизма тирозина). У таких больных наблюдают недостаточность фермента окисления гомогентизиновой кислоты - диоксигеназы гомогентизиновой кислоты, приводящей к развитию заболевания. В результате увеличиваются концентрация гомогентизиновой кислоты и выведение её с мочой. В присутствии кислорода гомогентизиновая кислота превращается в соединение чёрного цвета - алкаптон. Поэтому моча таких больных на воздухе окрашивается в чёрный цвет. Кроме этого, распространенными первичными энзимопатиями являются галактоземия, недостаточность лактазы и сахаразы, различные липидозы.
Вторичные (приобретенные) энзимопатии возникают как следствие заболеваний органов, вирусных инфекций и т.п., что приводит к нарушению синтеза фермента или условий его работы, например, гипераммониемия при заболеваниях печени, при которых ухудшается синтез мочевины и в крови накапливается аммиак. Другим примером может служить недостаточность ферментов желудочно-кишечного тракта при заболеваниях желудка, поджелудочной железы или желчного пузыря.
Недостаток витаминов и их коферментных форм также является причиной приобретенных ферментопатий.
Использование ферментов в медицине происходит по четырем направлениям:
1. энзимодиагностика (это исследование активности ферментов плазмы крови, мочи, слюны с целью диагностики тех или иных заболеваний. Примером может служить фермент лактатДГ, определение его активности в плазме крови необходимо при заболеваниях сердца, печени, скелетной мускулатуры. Увеличение активности α-амилазы в плазме крови и моче наблюдается при воспалительных процессах в поджелудочной и слюнных железах. С другой стороны, заболевания тех или иных органов всегда сопровождаются специфичным "ферментативным профилем". Например, инфаркт миокарда сопровождается увеличением активности лактатДГ, креатинкиназы, аспартатаминотрансферазы),
2. энзимотерапия (использование ферментов в качестве лекарственных средств. Самыми распространенными ферментативными препаратами являются комплексы ферментов желудочно-кишечного тракта (Фестал, Мезим форте), содержащие пепсин, трипсин, амилазу и т.п., и используемые для заместительной терапии при нарушениях переваривания веществ в желудочно-кишечном тракте. Рибонуклеаза и дезоксирибонуклеаза входят в состав глазных капель для лечения вирусных конъюнктивитов. Трипсин ингалируют при бронхолегочных заболеваниях для разжижения густой и вязкой мокроты. Коллагеназу применяют для ускорения отторжения некротизированных тканей, для очистки трофических язв),
3. использование ферментов в медицинских технологиях и промышленности (Специфичность ферментов к определенным субстратам применяетсяв лабораторной диагностике. Многие лабораторные методы основаны на взаимодействии добавляемого извне фермента с определяемым соединением. В результате возникает специфичный продукт реакции, после определения содержания последнего судят о концентрации искомого вещества (глюкозооксидазный, холестеролоксидазный методы), иммуноферментные методы, основанные на образовании тройного комплекса фермент-антиген-антитело. Определяемое вещество не является субстратом фермента, но является антигеном. Фермент может присоединять этот антиген вблизи от активного центра. Если в среде есть антиген, то при добавлении антител и формировании тройного комплекса активность фермента изменяется. Активность фермента измеряют любым способом),
4. применение ингибиторов ферментов (Весьма широко применяются в настоящее время ингибиторы протеаз (контрикал, гордокс) при панкреатитах – состояниях, когда происходит активирование пищеварительных ферментов в протоках и клетках поджелудочной железы. Ингибиторы холинэстеразы (физостигмин, прозерин) приводят к накоплению нейромедиатора ацетилхолина в синапсах и показаны при миастении, двигательных и чувствительных нарушениях при невритах, радикулитах, психогенной импотенции. Препараты, содержащие ингибиторы моноаминоксидазы (наком, мадопар), повышают выработку нейромедиаторов катехоламинов в ЦНС при лечении паркинсонизма. Подавление активности моноаминооксидазы (разрушающей катехоламины) сохраняет нормальную передачу сигналов в нервной системе.
Ингибиторы ангиотензинпревращающего фермента (каптоприл, эналаприл и т.п.) используются как антигипертензивное средство и вызывают расширение периферических сосудов, уменьшение нагрузки на миокард, снижение артериального давления. Аллопуринол – ингибитор ксантиноксидазы, фермента катаболизма пуринов, требуется для снижения образования мочевой кислоты и подавления развития гиперурикемии и подагры. Ингибиторы гидроксиметилглутарил-SКоА-редуктазы (ловастатин, флувастатин, аторвастатин) применяются для снижения синтеза холестерола при атеросклерозе, заболеваниях сердечно-сосудистой системы, дислипопротеинемиях. Ингибитор карбоангидразы (ацетазоламид) используется как мочегонное средство при лечении глаукомы, отеков, эпилепсии, алкалозах и горной болезни).
8. Понятие о катаболизме и анаболизме и их взаимосвязи. Эндергонические и экзергонические реакции в метаболизме. Способы передачи электронов. Особенности протекания окислительных реакций в организме. Этапы расщепления веществ и освобождения энергии (этапы катаболизма).
Метаболизм представляет собой высоко координированную и целенаправленную клеточную активность, обеспеченную участием многих взаимосвязанных ферментативных систем, и включает два неразрывных процесса анаболизм и катаболизм. Он выполняет три специализированные функции:
1. Энергетическая – снабжение клетки химической энергией,
2. Пластическая – синтез макромолекул как строительных блоков,
3. Специфическая – синтез и распад биомолекул, необходимых для выполнения специфических клеточных функций.
Анаболизм– это биосинтез белков, полисахаридов, липидов, нуклеиновых кислот и других макромолекул из малых молекул-предшественников. Поскольку он сопровождается усложнением структуры, то требует затрат энергии (эндергонические реакции). Источником такой энергии является энергия АТФ. Также для биосинтеза некоторых веществ (жирные кислоты, холестерол) требуются богатые энергией атомы водорода – их источником является НАДФН. Молекулы НАДФН образуются в реакциях окисления глюкозо-6-фосфата в пентозном пути и оксалоацетата малик-ферментом. В реакциях анаболизма НАДФН передает свои атомы Н2 на синтетические реакции и окисляется до НАДФ. Так формируется НАДФ-НАДФН-цикл.
Катаболизм – расщепление и окисление сложных органических молекул до более простых конечных продуктов. Оно сопровождается высвобождением энергии, заключенной в сложной структуре веществ (экзергонические реакции). Большая часть высвобожденной энергии рассеивается в виде тепла. Меньшая часть этой Е "перехватывается" коферментами окислительных реакций НАД и ФАД, некоторая часть сразу используется для синтеза АТФ. Следует заметить, что атомы водорода, высвобождаемые в реакциях окисления веществ, могут использоваться клеткой только по двум направлениям: 1)на анаболические реакции в составе НАДФН; 2)на образование АТФ в митохондриях при окислении НАДН и ФАДН2 .
Весь катаболизм условно подразделяется на три этапа:
I этап. Специфический. Происходит в кишечнике (переваривание пищи) или в лизосомах при расщеплении уже ненужных молекул. При этом освобождается около 1% энергии, заключенной в молекуле. Она рассеивается в виде тепла.
II этап. Специфический. Вещества, образованные при внутриклеточном гидролизе или проникающие в клетку из крови, на втором этапе обычно превращаются в пировиноградную кислоту, ацетильную группу (в составе ацетил-S-КоА) и в некоторые другие мелкие органические молекулы. Локализация второго этапа – цитозоль и митохондрии. Часть энергии рассеивается в виде тепла и примерно 13% энергии вещества усваивается, т.е. запасается в виде макроэргических связей АТФ.
III этап. Общий, неспецефический. Все реакции этого этапа идут в митохондриях. Ацетил-SКоА включается в реакции цикла трикарбоновых кислот и окисляется до углекислого газа. Выделенные атомы водорода соединяются с НАД и ФАД и восстанавливают их. После этого НАДН и ФАДН2 переносят водород в цепь дыхательных ферментов, расположенную на внутренней мембране митохондрий. Здесь в результате процесса под названием "окислительное фосфорилирование" образуется вода и главный продукт биологического окисления – АТФ. Часть выделенной на этом этапе энергии молекулы рассеивается в виде тепла и около 46% энергии исходного вещества усваивается, т.е. запасается в связях АТФ и ГТФ.
Окислительно-восстановительными называются такие реакции, в процессе которых
происходит перенос электронов от восстановителя к окислителю. Существует четыре способа передачи электронов от одной молекулы к другой: 1. Прямой перенос электронов.2. Перенос электрона в составе атома водорода.3. Перенос двух электронов в составе гидрид-иона.4. Перенос электронов на О2 путем присоединения оного к молекуле-восстановителю.
Процессы катаболизма в клетках животных сопровождаются потреблением кислорода, который необходим для реакций окисления. В результате этих реакций происходит освобождение энергии, которая необходима организмам в процессах жизнедеятельности для осуществления различных видов работы. Небиологические системы могут совершать работу за счёт тепловой энергии, биологические системы функционируют в изотермическом режиме и для осуществления процессов жизнедеятельности используют химическую энергию. Под окислением понимают отщепление электронов, а под восстановлением - присоединение электронов. Окисление донора электронов всегда сопровождается восстановлением акцептора электронов. Этот принцип окислительно-восстановительных процессов применим и к биохимическим системам. В любой окислительно-восстановительной реакции участвует акцептор электронов (окислитель) и донор электронов (восстановитель). В каждой из них участвует окисленная и восстановленная форма одного соединения; их называют сопряжённой парой, или редокспарой. Способность восстановителя отдавать электрон окислителю выражают стандартным
окислительно-восстановительным потенциалом (Е0). Величину окислительно-
восстановительного потенциала (в вольтах) конкретной окислительно-восстановительной пары
определяют путем сравнения со стандартом. Чем выше величина стандартного окислительно-восстановительного потенциала некоторой окислительно-восстановительной пары, тем выше способность этой пары принимать электроны. Поток электронов всегда направлен таким образом, чтобы в результате свободная энергия системы уменьшалась. Е, высвобождаемая в реакциях катаболизма, запасается в виде связей, называемых макроэргическими. Основной и универсальной молекулой, которая запасает энергию и при необходимости отдает ее, является АТФ. Все молекулы АТФ в клетке непрерывно участвуют в каких-либо реакциях, постоянно расщепляются до АДФ и вновь регенерируют. Существует три основных способа использования АТФ:1)биосинтез веществ, 2)транспорт веществ через мембраны, 3)изменение формы клетки и ее движение.
Эти процессы вкупе с процессом образования АТФ получили название АТФ-цикл.
9. Оксидоредуктазы. Классификация. Характеристика подклассов. НАД-зависимые дегидрогеназы. Строение окисленной и восстановленной форм. Важнейшие субстраты НАД-зависимых дегидрогеназ. ФАД-зависимые дегидрогеназы: сукцинатдегидрогеназа и ацилКоА-дегидрогеназа.
Ферменты этого класса катализируют окислительно-восстановительные реакции, лежащие в основе биологического окисления. Класс насчитывает 22 подкласса. Коферментами этого класса являются НАД, НАДФ, ФАД, ФМН, убихинон, глутатион, липоевая кислота.
Примером подклассов могут служить ферменты, действующие на СН-ОН-группу доноров, на СH-СН-группу доноров, на СН-NН2-группу доноров, на гемсодержащие доноры.
Наиболее распространены следующие рабочие названия оксидоредуктаз:
1. Дегидрогеназы – оксидоредуктазы, катализирующие дегидрирование субстрата с использованием в качестве акцептора водорода любых молекул, кроме кислорода.
Дата добавления: 2015-07-24; просмотров: 1129;
