Последовательность реакций цитратного цикла
1. Образование цитрата. В реакции образования цитрата углеродный атом метильной труппы ацетил-КоА связывается с карбонильной группой оксалоацетата; одновременно расщепляется тиоэ-фирная связь и освобождается коэнзим A. Катализирует реакцию цитрат синтаза, фермент, локализованный в матриксе митохондрий.
2. Превращение цитрата в изоцитрат. Вторая реакция цитратного цикла - обратимое превращение цитрата в изоцитрат. Фермент, катализирующий эту реакцию, назван аконитазой по промежуточному продукту, цис-аконитовой кислоте, которая предположительно образуется в реакции.
3. Окислительное декарбоксилирование изоцитрата. Эту реакцию катализирует изоцитратдегидрогеназа. Существуют 2 формы изоцитратдегидрогеназы: одна содержит в качестве коферментa NAD+, вторая - NADP+. NAD-зависимый фермент локализован в митохондриях и участвует в ЦТК; NADP-зависимый фермент, присутствующий и в митохондриях, и В) цитоплазме, играет иную метаболическую роль, В результате действия этого фермента на изоцитрат образуется α-кетоглутарат. Реакция, катализируемая NAD-зависимой изоцитратдегидрогеназой, - самая медленная реакция цитратного цикла. АДФ - аллостерический активатор фермента.
4. Окислительное декарбоксилирование α-кетоглутарата. В этой реакции α-кетоглутарат подвергается окислительному декарбоксилированию с образованием в качестве конечных продуктов сукцинил-КоА, СО2 и NADH + Н+. В результате этой реакции образуется сукцинил-КоА. Реакцию катализирует α-кетоглутаратдегидрогеназный комплекс, который по структуре и функциям сходен с пируватдегидрогеназным комплексом. Подобно ПДК, он состоит из 3 ферментов: α-кетоглутаратдекарбоксилазы, дигидролипоилтранссукцинилазы и дигидролипоилдегидрогеназы. Кроме того, в этот ферментный комплекс входят 5 коферментов: тиаминдифосфат, кофермент А, липоевая кислота, NAD+ и FAD.
5. Превращение сукцинил-КоА в сукцинат. Сукцинил-КоА - высокоэнергетическое соединение. В митохондриях разрыв тиоэфирной связи сук-цинил-КоА сопряжён с реакцией фосфорилирования гуанозиндифосфата (ГДФ) до гуанозинтрифосфата (ГТФ). Эту сопряжённую реакцию катализирует сукцинаттиокиназа. Промежуточный этап реакции - фосфорилирование молекулы фермента по одному из гистидиновых остатков активного центра. Затем остаток фосфорной кислоты присоединяется к ГДФ с образованием ГТФ. С ГТФ концевая фосфатная группа может переноситься на АДФ с образованием АТФ; эту обратимую реакцию катализирует нуклеозид-дифосфаткиназа. Образование высокоэнергетической фосфо-ангидридной связи за счёт энергии субстрата (сукцинил-КоА) - пример субстратного фосфорилирования.
6. Дегидрирование сукцината. Образовавшийся на предьщущем этапе сукцинат превращается в фумарат под действием сукцинатдегидрогеназы. Этот фермент - флавопротеин, молекула которого содержит прочно связанный кофермент FAD. Сукцинат дегидрогеназа прочно связана с внутренней митохондриальной мембраной. Она состоит из 2 субъединиц, одна из которых связана с FAD. Кроме того, обе субъединицы содержат железо-серные центры; одна - Fe2S2, a другая - Fe4S4. В железо-серных центрах атомы железа меняют свою валентность, участвуя в транспорте электронов.
7. Образование малата из фумарата. Образование малата происходит при участии фермента фумаратгидратазы. Этот фермент более известен как фумараза. Фумараза - олигомерный белок, состоящий из 4 идентичных полипептидных цепей. Он расположен в матриксе митохондрий. Фумаразу относят к ферментам с абсолютной субстратной специфичностью: она катализирует гидратацию только транс-формы фумарата.
8. Дегидрирование малата. В заключительной стадии цитратного цикла малат дегидрируется с образованием оксалоа-цетата. Реакцию катализирует NAD-зависимая малатдегидрогеназа, содержащаяся в матриксе митохондрий.
За 1 оборот цикла при окислении ацетил-КоА образуется: а) 2 молекулы СО2 б) 3 молекулы НАДН в) 1 молекула ФАДН2 г) 1 молекула АТФ (от субстратного фосфрилирования). Регуляция:
Ключевые ферменты Активаторы Ингибиторы
Цитаратсинатаза Ацетил-КоА, оксалоацетат АТФ, НАДН, сукцинил-КоА,
(начальный) динноцепочечные жирные кислоты
Изоцитратдегидрогеназа АДФ(аллостерический), АТФ, НАДН, НАДФН
(лимитирующий) цАМФ, Са2+
L-кетоглутаратдегидрогеназа цАМФ, Са2+ сукцинил-КоА, АТФ, НАДН
(фермент на развилке)
Значение: 1) Анаболическое: а) Катаболическая, т.к. в нём происходит распад ацетильных остатков, полученных из белков, липидов и углеводов; б) Анаболическая, т.к. субстраты цикла используются для синтеза др соединений (оксалоацетат, сукцинат – на синтез заменимых АК). 2) Энергетичекая – за 2 цикл образуется 1 АТФ. 3) Является основным поставщиком Н2 для дыхательной цепи, в составе НАДН и ФАДН2. 4) Регуляторная: продукты цикла являются регуляторами других процессов (АТФ и цитрат тормозят расщепление глюкозы, о стимулируют синитез ж. кислот.
11. Дыхательная цепь, компоненты, структурная организация. Электрохимический потенциал, его значение.
Дыхательная цепь – это совокупность red-ox реакций в результате которых Н2 и электроны переносятся на О2 с выделением Н2О и энергии. В результате окислительных реакций в цикле Кребса, катализируемых дегидрогеназами, протоны и электроны переходят от органических субстратов на кофакторы НАД и ФАД, восстанавливая их в НАДН иФАДН2. Эти вещества обладают высоким энергетическим потенциалом. Электроны от них передаются на О2 ч/з ряд red-ox реакций. Окисление органических веществ в клетках сопровождающееся потреблением О2 и образованием Н2О называется тканевым дыханием, а цепь переноса электронов – дыхательной цепью.
Молекулы НАДН и ФАДН2, образуемые в реакциях окисления углеводов, жирных кислот, спиртов и АК, далее поступают в митохондрии, где ферментами дыхательной цепи осуществляется процесс окислительного фосфорилирования.
Дыхательная цепь является частью процесса окислительного фосфорилирования. Компоненты дыхательной цепи катализируют перенос электронов от НАДН + Н+ или восстановленного убихинона (QH2) на молекулярный кислород. Из-за большой разности окислительно-восстановительных потенциалов донора (НАДН + Н+ и, соответственно, (QH2) и акцептора (О2) реакция является высокоэкзергонической. Большая часть выделяющейся при этом энергии используется для создания градиента протонов и, наконец, для образования АТФ с помощью АТФ-синтазы.
Принцип работы дыхательной цепи:
1) Образующиеся в реакциях катаболизма НАДН и ФАДН2 передают атомы водорода (т.е. протоны водорода и электроны) на ферменты дыхательной цепи.
2) Электроны движутся по ферментам дыхательной цепи и теряют энергию.
3)Эта энергия используется на выкачивание протонов Н+ из матрикса в межмембранное пространство.
4) В конце дыхательной цепи электроны попадают на кислород и восстанавливают его до воды.
5) Протоны Н+ стремятся обратно в матрикс и проходят через АТФ-синтазу.
6) При этом они теряют энергию, которая используется для синтеза АТФ.
Таким образом, восстановленные формы НАД и ФАД окисляются ферментами дыхательной цепи, благодаря этому происходит присоединение фосфата к АДФ, т.е. фосфорилирование. Поэтому весь процесс целиком получил название окислительное фосфорилирование.
Всего цепь переноса электронов включает в себя около 40 разнообразных белков, которые организованы в 4 больших мембраносвязанных мульферментных комплекса. Также существует еще один комплекс, участвующий не в переносе электронов, а синтезирующий АТФ.
В дыхательной цепи есть 2 входа: 1. Протоны поступают в цепь ч/з НАДН; 2. В составе ФАДН2
Характеристика компонентов дыхательной цепи (ферментативных комплексов):
1)НАДН-дегидрогеназа (НАДН-КоQ-оксидоредуктаза) – встроена во внутреннюю мембрану митохондрий. Это флавин-зависимый фермент, в состав которого входит витамин В2. Сложный, имеет 2 простетические группы: ФМН (флавинмононуклеотид – активная форма витамина В2) и Железосерные белки (FеS-белки). Атомы Fe, входящие в FеS-центры являются негеминовыми (не входят в состав гема). Активный центр НАДНДГ обращён в сторону матрикса митохондрий. НАДНДГ дегедрирует НАДН (отщепляет Н2) и передаёт протоны и электроны сначала на ФМН, а потом ч/з FеS-центры на СоQ(восстанавливается и превращается в КоQН2 или убихинол).
Функция: а)Принимает электроны от НАДН и передает их на коэнзим Q (убихинон).
б) Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны.
2) КоQ (убихинон) – небелковый переносчик, находится в растворенном состоянии, т.к. является жирорастворимым (растворяется в липидном слое мембран). Поэтому может перемещаться как вдоль так и поперек мембраны (не заряжен). Поэтому он принимает электроны и протоны с ФАДН2, т.е. ч/з 2й вход в дыхательную цепь. Его называют коллектором электронов.
3) Цитохромы (b, c1, c, а, а3) – сложные белки (гемпротеины), небелковой частью которых является гем, содержащий Fе3+ (окисленная форма). Fе гема может обратимо принимать и отдавать электроны.
4) УбихинолДГ (КоQ-цитохром с-оксидоредуктаза) – это ферментный комплекс, состоящий из цитохромов b и с1, включающий также FеS-центры. Функция:
а) Принимает электроны от коэнзима Q и передает их на цитохром с (при этом Fе восстанавливается до 2х валентного); б)Переносит 2 иона Н+ на наружную поверхность внутренней митохондриальной мембраны.
5) Цитохром с-кислород-оксидоредуктаза- В этом комплексе находятся цитохромы а и а3, он называется также цитохромоксидаза, всего содержит 6 полипептидных цепей. В комплексе также имеется 2 иона меди. Функция: а) Принимает электроны от цитохрома с и передает их на кислород с образованием воды. б)Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны.
6) АТФ-синтаза – комплекс, состоящий из множества белковых цепей, подразделенных на две большие группы: одна группа формирует субъединицу Fо (произносится со звуком "о", а не "ноль" т.к олигомицин-чувствительная) – ее функция каналообразующая, по ней выкачанные наружу протоны водорода устремляются в матрикс. Другая группа образует субъединицу F1 – ее функция каталитическая, именно она, используя энергию протонов, синтезирует АТФ.
«Хемиоосматическая теория сопряжения, окисления и фосфорилирования» Митчел:
«Перенос электронов по дыхательной цепи от НАДН к О2 сопровождается выкачиванием протонов из матрикса митохондрий ч/з внутреннюю мембрану в межмембранное пространство. Перенос протонов осуществляется за счет свободной энергии, освобождающейся при переносе электронов по градиенту окислительно-восстановительного потенциала.»
Протоны вернуться в матрик не могут, т.к. внутренняя мембрана митохондрий непроницаема для них и для других заряженных частиц. В результате на внешней стороне внутренней мембраны сосредотачиваются «+» заряды, а на внутренней «-». На мембране возникает разность электрических потенциалов (ΔΨ, "дельта пси"). Протоны накапливаются в межмембранном пространстве, рН снижается, т.е. среда будет кислая. А в матриксе протонов меньше, возникает градиент химического потенциала (ΔрН). à ΔμH+ = ΔΨ + ΔрН (электрохимический потенциал Митчела).
Наиболее активный транспорт протонов в межмембранное пространство происходит в пунктах сопряжения, оксиления и фосфорилирования. Важную роль в процессе транспорта протонов выполняет КоQ. На каждую переносимую пару электронов по дыхательной цепи от НАДН к О2 вырабатывается 3 пары протонов. Если электроны переносятся с ФАДН2, то 2 пары протонов. Протоны могут вернутся в матрикс только по ионным каналам фермента АТФ-синтазы.
ΔμH+, генерируемый за счет протонов в каждом из пунктов сопряжения используется для синтеза 1й молекула АТФ. Синтезируемая АТФ переходит в матрикс митохондрий.
12. Окислительное фосфорилирование АДФ. Механизм. Сопряжение и разобщение окисления и фосфорилирования в дыхательной цепи. Коэффициент Р/0. Регуляция дыхательной цепи.
На основании строения и функций компонентов дыхательной цепи предложен механизм окислительного фосфорилирования:
1. Ферменты дыхательной цепи расположены в строго определенной последовательности: каждый последующий белок обладает большим сродством к электронам, чем предыдущий (он более электроположителен, т.е. обладает более положительным окислительно-восстановительным потенциалом). Это обеспечивает однонаправленное движение электронов.
2. Все атомы водорода, отщепленные дегидрогеназами от субстратов в аэробных условиях, достигают внутренней мембраны митохондрий в составе НАДН или ФАДН2.
3. Здесь атомы водорода (от НАДН и ФАДН2) передают свои электроны в дыхательную ферментативную цепь, по которой электроны движутся (50-200 шт/сек) к своему конечному акцептору – кислороду. В результате образуется вода.
4. Поступающие в дыхательную цепь электроны богаты свободной энергией. По мере их продвижения по цепи они теряют энергию.
 Часть энергии электронов используется I, III, IV комплексами дыхательных ферментов для перемещения ионов водорода через мембрану в межмембранное пространство. Другая часть рассеивается в виде тепла. Упрощенно сказанное представить в виде равенства:
Часть энергии электронов используется I, III, IV комплексами дыхательных ферментов для перемещения ионов водорода через мембрану в межмембранное пространство. Другая часть рассеивается в виде тепла. Упрощенно сказанное представить в виде равенства:
5. Перенос ионов водорода через мембрану (выкачивание) происходит не случайно, а в строго определенных участках мембраны. Эти участки называются участки сопряжения (или, не совсем точно, пункты фосфорилирования). Они представлены I, III, IV комплексами дыхательных ферментов. В результате работы этих комплексов формируется градиент ионов водорода между внутренней и наружной поверхностями внутренней митохондриальной мембраны. Такой градиент обладает потенциальной энергией.
Градиент (Δμ, "дельта мю") получил название электрохимический градиент или протонный градиент. Он имеет две составляющие – электрическую (ΔΨ, "дельта пси") и концентрационную (ΔрН):
Δμ = ΔΨ + ΔрН
Название "участки сопряжения" возникло из-за того, что появление протонного градиента в результате окислительных процессов обеспечивает в дальнейшем фосфорилирование АДФ до АТФ (см п.п.6). Именно благодаря этим трем ферментным комплексам энергия реакций окисления может передаваться на фосфорилирование, т.е. существует сопряжение (связывание) двух процессов.
 6. Как завершение всех предыдущих событий и необходимый их результат происходит наработка АТФ: ионы H+ теряют свою энергию, проходя через АТФ-синтазу (Н+-транспортирующая АТФ-аза, КФ 3.6.3.14.). Часть этой энергии тратится на синтез АТФ. Другая часть рассеивается в виде тепла:
6. Как завершение всех предыдущих событий и необходимый их результат происходит наработка АТФ: ионы H+ теряют свою энергию, проходя через АТФ-синтазу (Н+-транспортирующая АТФ-аза, КФ 3.6.3.14.). Часть этой энергии тратится на синтез АТФ. Другая часть рассеивается в виде тепла:
Сопряжение в дыхательной цепи — это такое состояние, когда окисление (перенос электронов) сопровождается фосфорилированием, то есть синтезом АТФ.Разобщение — это такое состояние дыхательной цепи, когда окисление идет, а фосфорилирование не происходит, то есть пункты фосфорилирования выключены полностью или частично. В этом случае вся или какая-то часть образующейся энергии выделяется в виде тепла. Разобщение в дыхательной цепи могут вызывать липофиль-ные вещества, которые способны переносить протоны водорода с внешней стороны внутренней мембраны митохондрий на внутреннюю, минуя АТФ-синтетазу. В результате вся энергия мембранного потенциала будет рассеиваться в виде тепла. Разобщение вызывают: 2,4-ДНФ (динитрофенол), многие яды промышленных производств, бактериальные токсины, набухание митохондрий, жирные кислоты, ионофоры (вещества, переносящие ионы через мембрану). Разобщители повышают скорость переноса электронов по дыхательной цепи и выводят ее из под контроля АТФ.
Вещества, которые снижают величину электрохимического градиента, приводя к увеличению скорости движения электронов по ферментам дыхательной цепи, уменьшению синтеза АТФ и возрастанию катаболизма называются разобщители. Они разобщают (разъединяют) процессы окисления и фосфорилирования внутренней мембраны митохондрий. К разобщителям в первую очередь относят "протонофоры" – вещества переносящие ионы водорода. При этом одновременно уменьшаются оба компонента электрохимического градиента – электрический и химический, и энергия градиента рассеивается в виде тепла. Следствием эффекта протонофоров является возрастание катаболизма жиров и углеводов в клетке и во всем организме.
Классическим протонофором является динитрофенол, жирорастворимое соединение, присоединяющие ионы водорода на внешней поверхности внутренней митохондриальной мембраны и отдающие их на внутренней поверхности. Белок термогенин является физиологическим протонофором.
Кроме динитрофенола и термогенина протонофорами, к примеру, являются салицилаты, жирные кислоты и трийодтиронин.
яд веществ может ингибировать ферменты дыхательной цепи и блокировать движение электронов от НАДН и ФАДН2 на кислород. Они называются ингибиторы. В результате прекращается движение электронов, выкачивание ионов Н+ и работа АТФ-синтазы. Синтез АТФ отсутствует и клетка погибает. Выделяют три основных группы ингибиторов:
1. действующие на I комплекс, например, амитал (производное барбитуровой кислоты), ротенон, прогестерон,
2. действующие на III комплекс, например, экспериментальный антибиотик антимицин А,
3. действующие на IV комплекс, например, сероводород (H2S), угарный газ (СО), цианиды (-CN).
Энергетическую ценность и выгодность окисления вещества можно подсчитать. Количество запасенной энергии при окислении того или иного соединения характеризует количество АТФ, а эффективность использования энергии вещества и ее захвата – коэффициент P/O.Коэффициент Р/О – это коэффициент сопряжения окисления и фосфорилирования. Это количество моль АТФ, синтезируемых из АДФ и Н3РО4 на каждый полноценный грамм-атом поглощенного О2. Для субстратов пируват, изоцитрат, малат окисляющимися Над-зависимыми ДГ коэффициент Р/О=3. Для сукцината (ФАД-зависимая ДГ) =2. Если Р/О для пирувата=3 – митохондрии находятся в сопряженном состоянии.
Работа дыхательных ферментов регулируется с помощью эффекта, который получил название дыхательный контроль. Дыхательный контроль – это прямое влияние электрохимического градиента на скорость движения электронов по дыхательной цепи (т.е. на величину дыхания). В свою очередь, величина градиента напрямую зависит от соотношения АТФ и АДФ, количественная сумма которых в клетке практически постоянна ([АТФ] + [АДФ] = const). Реакции катаболизма направлены на поддержание постоянно высокого уровня АТФ и низкого АДФ.
Возрастание протонного градиента возникает при снижении количества АДФ и накоплении АТФ (состояние покоя), т.е. когда АТФ-синтаза лишена своего субстрата и ионы Н+ не проникают в матрикс митохондрии. При этом ингибирующее влияние градиента усиливается и продвижение электронов по цепи замедляется. Ферментные комплексы остаются в восстановленном состоянии. Следствием является уменьшение окисления НАДН и ФАДН2 на I и II комплексах и замедление катаболизма в клетке. Снижение протонного градиента возникает при исчерпании резервов АТФ и избытке АДФ , т.е. при работе клетки. В этом случае активно работает АТФ-синтаза и через канал Fо проходят в матрикс ионы Н+. При этом градиент, естественно, снижается, поток электронов возрастает, в результате повышается выкачивание ионов Н+ в межмембранное пространство и снова их быстрое "проваливание" через АТФ-синтазу внутрь митохондрий с синтезом АТФ. Ферментные комплексы I и II усиливают окисление НАДН и ФАДН2 (как источников электронов) и снимается ингибирующее влияние НАДН на цикл лимонной кислоты и пируватдегидрогеназный комплекс. Как итог – активируются реакции катаболизма углеводов и жиров.
В клетке часто может создаваться ситуация, когда реакции окислительного фосфорилирования идут с определенными вариациями. Эти вариации могут являться следствием нарушений в организме или физиологической реакцией на воздействие.
Гипоэнергетические состояния.Причиной гипоэнергетических состояний может быть следующее:
-гиповитаминозы экзогенные и/или эндогенные – снижается скорость и эффективность окислительных реакций. Возникает обычно при нехватке витаминов – В1, В2, никотиновой кислоты, В6, пантотеновой кислоты и аскорбиновой кислоты,
-дефицит белка в пище – снижается синтез всех ферментов и ферментов катаболизма в частности,
снижение потребления углеводов и липидов как основных источников энергии,
-дефицит кислорода – отсутствие акцептора для электронов вызывает "переполнение" дыхательных ферментов, повышение электрохимического градиента, накопление НАДН и ФАДН2 в клетке и прекращение катаболизма,
-дефицит железа – компонента цитохромов, миоглобина и гемоглобина, и меди – компонента цитохромоксидазы.
13. Субстратное фосфорилирование АДФ. Отличия от окислительного фосфорилирования. Основные пути использования АТФ. Цикл АДФ-АТФ. Понятие о свободном окислении и его значение. Тканевые особенности окислительно-восстановительных процессов.
АТФ - молекула, богатая энергией, поскольку она содержит две фосфоаншдридные связи (β, γ). При гидролизе концевой фосфоангидридной связи АТФ превращается в АДФ и ортофосфат Рi Величина свободной энергии гидролиза АТФ делает возможным его образование из АДФ за счёт переноса фосфатного остатка от таких высокоэнергетических фосфатов, как, например, фосфоенолпируват. В свою очередь, АТФ может участвовать в таких эндергонических реакциях, как фосфорилирование глюкозы или глицерина. АТФ выступает в роли донора энергии в эндергонических реакциях многих анаболических процессов. Наконец, за счёт свободной энергии АТФ совершаются различные виды работы, лежащие в основе жизнедеятельности организма, например, такие как мышечное сокращение или активный транспорт веществ. Таким образом, АТФ - главный, непосредственно используемый донор свободной энергии в биологических системах. В клетке молекула АТФ расходуется в течение одной минуты после её образования. У человека количество АТФ, равное массе тела, образуется и разрушается каждые 24 ч. Основным способом получения АТФ в клетке является окислительное фосфорилирование, протекающее в структурах внутренней мембраны митохондрий. При этом энергия атомов водорода молекул НАДН и ФАДН2, образованных в гликолизе, ЦТК, окислении жирных кислот, преобразуется в энергию связей АТФ. Однако также есть другой способ фосфорилирования АДФ до АТФ – субстратное фосфорилирование, поскольку он является частью метаболического пути («субстратной цепи»).Их особенностью является катализирование растворимыми ферментами. Этот способ связан с передачей макроэргического фосфата или энергии макроэргической связи какого-либо вещества (субстрата) на АДФ. К таким веществам относятся метаболиты гликолиза (1,3-дифосфоглицериновая кислота, фосфоенолпируват), цикла трикарбоновых кислот (сукцинил-SКоА) и креатинфосфат. Энергия гидролиза их макроэргической связи выше, чем 7,3 ккал/моль в АТФ, и роль указанных веществ сводится к использованию этой энергии для фосфорилирования молекулы АДФ до АТФ. Отличия: разные источники энергии, для окислительного необходимы движение электронов в дых цепи, для субстратного необ-ма энергия макроэргической связи.
Существует три основных способа использования АТФ: 1. биосинтез веществ, 2. транспорт веществ через мембраны,
3. изменение формы клетки и ее движение. Эти процессы вкупе с процессом образования АТФ получили название АТФ-цикл:
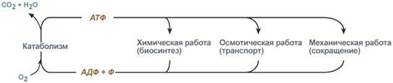 Использование АТФ как источника Е возможно только при условии непрерывного синтеза АТФ из АДФ за счёт Е окисления орг-их соединений. Цикл АТФ-АДФ - основной механизм обмена энергии в биологических системах.
Использование АТФ как источника Е возможно только при условии непрерывного синтеза АТФ из АДФ за счёт Е окисления орг-их соединений. Цикл АТФ-АДФ - основной механизм обмена энергии в биологических системах.
Свободное окисление. Одна из задач свободного (несопряженного) окисления – превращения природных или неприродных субстратов, называемых в этом случае ксенобиотиками (ксено – несовместимый, биос – жизнь). Они осуществляются ферментами диоксигеназами и монооксигеназами. Окисление протекает при участии специализированных цитохромов, локализованных чаще всего в эндоплазматическом ретикулуме, поэтому иногда этот процесс называют микросомальным окислением. В реакциях свободного окисления участвуют также кислород и восстановленные дыхательные переносчики (чаще всего НАДФН). Акцептором электронов является цитохром Р-450 (иногда цитохром b5). Окисление субстрата протекает по следующей схеме: SH + O2–> SOH. Ферменты свободного окисления: оксидазы, оксигеназы, некоторые дегидрогеназы. Механизм действия оксигеназ включает изменение валентности входящих в их состав ионов двухвалентных металлов. Диоксигеназы присоединяют к субстрату молекулярный кислород, активируя его за счет электрона атома железа в активном центре. Монооксигеназы требуют участия в реакции НАДФН, атомы Н2 которого взаимодействуют с одним из атомов О2, поскольку только один электрон связывается с субстратом. В процессе свободного окисления вследствие особенностей используемых цепей передачи электронов не происходит образования АТФ; биологическая роль этих процессов заключается в метаболизме ряда природных и ксенобиотических субстратов. В последнем случае свободное окисление выполняет важную функцию модификации чужеродных соединений. К последним относятся лекарственные средства, гербициды, продукты загрязнения окружающей среды, в возрастающем количестве попадающие в организм с водой, пищей и атмосферным воздухом. Как правило, они имеют гидрофобные св-ва. Многие из них являются канцерогенными. Их гидроксилирование в ходе свободного окисления облегчает последующую деструкцию и выведение из организма. При свободном окислении высвобождающаяся при сопряженном с окислением распаде химических связей энергия переходит в тепловую и рассеивается. По типу свободного окисления идут все без исключения оксигеназные реакции, все окислительные реакции, ускоряемые пероксидазами или сопровождающиеся образованием Н202, многие реакции, катализируемые оксидазами. Процессы свободного окисления сосредоточены в цитозоле, в мембранах эндоплазматической сети клетки, в мембранах лизосом, пероксисом и аппарата Гольджи, на внешних мембранах митохондрий и хлоропластов. Они идут также в ядерном аппарате клетки.
Тканевые и возрастные особенности окислительных процессов. Анаэробные ткани могут получать энергию без кислорода. Такими тканями являются: скелетные мышцы, эритроциты, периферические нервы, мозговое вещество почек, кость, хрящ, соединительная ткань. Аэробные ткани получают энергию с использованием кислорода и полностью зависят от кровотока. К таким тканям относятся: головной мозг, сетчатка глаза, сердце, кора почек, печень, слизистая тонкого кишечника. Потребление кислорода, а значит, и интенсивность окислительных процессов с возрастом падают.
14. Функции углеводов. Потребность организма в углеводах. Переваривание углеводов. Нарушения переваривания и всасывания углеводов. Унификация моносахаридов. Роль печени в обмене углеводов.
Углеводы - это оксопроизводные многоатомных спиртов и продукты их конденсации. В организме человека имеется несколько десятков различных моносахаридов и разнообразные олиго‑ и полисахариды. Функции углеводов:
1. Углеводы служат источником энергии (главная роль принадлежит глюкозе и гликогену, около 57% суточного калоригенеза; Энергетич ценность 1 г+17,18 кДж).
2. Углеводы входят в состав структурно‑функциональных компонентов клеток. К ним относятся пентозы нуклеотидов и нуклеиновых кислот, углеводы гликолипидов и гликопротеинов, гетерополисахариды межклеточного вещества.
3. Из углеводов могут синтезироваться соединения других классов (липиды и аминокислоты).
4. Выполняют структурообразовательную функцию, то есть входят в состав клеточных и межклеточных структур (Углеводные структуры принимают участие и в др. высокоспецифич. явлениях клеточного взаимод., таких, как оплодотворение, узнавание клеток при тканевой дифференциации, отторжение чужеродных тканей и т. д. ).
К заболеваниям, связанным с патологией углеводного обмена относятся сахарный диабет, гликогенозы, агликогенозы, мукополисахаридозы, галактоземии и фруктоземии.
Потребностьв углеводах взрослого организма составляет 350-400 г в сутки, при этом целлюлозы и других пищевых волокон должно быть не менее 30-40 г.
С пищей в основном поступают крахмал, гликоген, целлюлоза, сахароза, лактоза, мальтоза, глюкоза и фруктоза, рибоза.
Переваривание углеводов в ЖКТ: 1. Ротовая полость: Со слюной сюда поступает кальций-содержащий фермент α-амилаза. Оптимум ее рН 7,1-7,2, активируется ионами Cl–. Являясь эндоамилазой, она беспорядочно расщепляет внутренние α1,4-гликозидные связи крахмала и гликогена и не влияет на другие типы связей. Т.к. переваривание в ротовой полости длится не долго углеводы расщепляются до декстринов и мальтозы. Дисахариды не гидролизуются. Пищевой комок далее перемещается по пищеводу в желудок. 2. В желудке собственных ферментов для переваривания углеводов нет. Переваривание происходит под действием α-амилазы слюны внутри пищевого комка, пока содержимое не пропитается желудочным соком. рН его=1,5-2,5, поэтому α-амилаза инактивируется. В желудочном содержимом возможен лишь незначительный кислотный гидролиз гликозидных связей. 3. Основной процесс переваривания происходит в верхнем отделе кишечника – 12-перстной кишке под действием панкреатической α-амилазы. Декстрины в результате гидролизуются до мальтозы. Этот процесс происходит в просвете кишки. В полости тонкого кишечника работают совместно панкреатическая α-амилаза, разрывающая внутренние α1,4-связи, изомальтаза, разрывающая α1,6-связи изомальтозы, олиго-α1,6-глюкозидаза, действующая на точки ветвления крахмала и гликогена. Ферменты, расщепляющие гликозидные связи в дисахаридах (дисахаридазы), образуют ферментативные комплексы, локализованные на наружной поверхности цитоплазматической мембраны энтероцитов:
-сахаразо-изомальтазный комплекс (рабочее название сахараза) – в тощей кишке гидролизует α1,2-, α1,4-, α1,6-гликозидные связи, расщепляет сахарозу, мальтозу, мальтотриозу, изомальтозу,
-гликоамилазный комплекс – находится в нижних отделах тонкого кишечника и расщепляет α1,4-гликозидные связи в олигосахаридах,
-β-гликозидазный комплекс (рабочее название лактаза) – гидролизует β1,4-гликозидные связи между галактозой и глюкозой (лактозу). У детей активность лактазы очень высока уже до рождения и сохраняется на высоком уровне до 5-7 лет, после чего снижается.
- Трегалаза - также гликозидазный комплекс, гидролизующий связи между мономерами в тре-галозе - дисахариде, содержащемся в грибах. Трегалоза состоит из двух глюкозных остатков, связанных гликозидной связью между первыми аномерными атомами углерода
Особенность переваривания углеводов в тонком кишечнике заключается в том, что активность специфических олиго- и дисахаридаз в просвете кишечника низкая. Но ферменты активно действуют на поверхности эпителиальных клеток кишечника.
Совместные действия перечисленных ферментов завершают переваривание пищевых углеводов с образованием моносахаров.
Целлюлоза ферментами человека не переваривается. Но в толстом кишечнике под действием микрофлоры до 75% ее количества гидролизуется с образованием целлобиозы и глюкозы. Глюкоза частично используется самой микрофлорой и окисляется до органических кислот (масляной, молочной), которые стимулируют перистальтику кишечника. Частично глюкоза может всасываться в кровь.
После переваривания начинается процесс всасывания. После переваривания крахмала и гликогена, после расщепления дисахаридов в полости кишечника накапливается глюкоза и другие моносахариды, которые должны попасть в кровь. Для этого им необходимо преодолеть, как минимум, апикальную мембрану энтероцита и его базальную мембрану. Всасывание моносахаридов из просвета кишечника происходит по механизму вторичного активного транспорта. Это значит, что затрата энергии при переносе сахаров происходит, но тратится она не непосредственно на транспорт молекулы, а на создание градиента концентрации другого вещества. В случае моносахаридов таким веществом является натрий. Фермент Na+,К+-АТФаза постоянно, в обмен на калий, выкачивает ионы натрия из клетки, именно этот транспорт требует затрат энергии. В просвете кишечника содержание натрия относительно высоко и он связывается со специфическим мембранным белком, имеющим два центра связывания: один для натрия, другой для сахара. Примечательно то, что сахар связывается с белком только после того, как с ним свяжется натрий. Белок-транспортер свободно мигрирует в толще мембраны. При контакте белка с цитоплазмой натрий быстро отделяется от него по градиенту концентрации и сразу отделяется сахар. Результатом является накопление сахара в клетке, а ионы натрия выкачиваются Na+,К+-АТФазой.
Выход глюкозы из клетки в межклеточное пространство и далее кровь происходит благодаря простой и облегченной диффузии. После выхода в кровь, оттекающую от кишечника, моносахариды движутся по сосудам воротной системы в печень, частично задерживаются в ней, частично выходят в большой круг кровообращения. Следующей их задачей стоит проникновение в клетки органов.
Из крови внутрь клеток глюкоза попадает при помощи облегченной диффузии по градиенту концентрации с участием белков-переносчиков (глюкозных транспортеров "ГлюТ"). Различают 5 видов транспортеров глюкозы ГлюТ 1, ГлюТ 2, ГлюТ 3, ГлюТ 4, ГлюТ 5. Глюкозные транспортеры имеются на мембранах всех клеток. В мышцах и жировой ткани находится ГлюТ 4, только эти транспортеры являются чувствительными к влиянию инсулина. При действии инсулина на клетку они поднимаются к поверхности мембраны и переносят глюкозу внутрь. Указанные ткани получили название инсулинзависимых.Некоторые ткани совершенно нечувствительны к действию инсулина, их называют инсулиннезависимыми. К ним относятся нервная ткань, стекловидное тело, хрусталик, сетчатка, клубочковые клетки почек, эндотелиоциты, семенники и эритроциты. Часть клеток занимает промежуточное положение, т.е. на их мембранах находятся ГлюТ 4 и другие типы транспортеров.
НАРУШЕНИЯ ПЕРЕВАРИВАНИЯ И ВСАСЫВАНИЯ УГЛЕВОДОВ. В основе патологии переваривания и всасывания углеводов могут быть причины двух типов: 1)дефекты ферментов, участвующих в гидролизе углеводов в кишечнике; 2) нарушение всасывания продуктов переваривания углеводов в клетки слизистой оболочки кишечника. В обоих случаях возникает осмотическая диарея, которую вызывают нерасщеплённые дисахариды или невсосавшиеся моносахариды. Всё вместе приводит к притоку воды в кишечник, увеличению объёма кишечного содержимого, усилению перистальтики, спазмам и болям, а также метеоризму.
Существуют две наиболее встречающиеся формы нарушения переваривания дисахаридов в кишечнике – дефект лактазы (β-гликозидазного комплекса) и сахаразы (сахаразо-изомальтазного комплекса), которые называются как интолерантность к лактозе и сахарозе или непереносимость лактозы и сахарозы. Приобретенная недостаточность. Приобретенные формы недостаточности переваривания углеводов возникают в результате заболеваний стенок ЖКТ: энтериты, колиты, когда нарушается образование ферментов и их размещение на щеточной каемке энтероцитов. К тому же ухудшается всасывание моносахаров. Наследственная недостаточность. При наследственной (первичной) патологии лактазы симптомы проявляются после первых кормлений. Патология сахаразы обнаруживается позднее, при введении в рацион сладкого.Недостаточность лактазы может проявляться не только у младенцев, но и в подростковом и взрослом возрасте, что является физиологическим возрастным изменением. Такая недостаточность широко распространена среди монголоидов и негроидов.
Патогенез: Отсутствие гидролиза соответствующих дисахаридов приводит к осмотическому эффекту и задержке воды в просвете кишечника.Кроме этого, сахара активно потребляются микрофлорой толстого кишечника и метаболизируют с образованием органических кислот (масляная, молочная) и газов. Из-за этого симптомами лактазной или сахаразной недостаточности являются диарея, срыгивания, метеоризм, вспучивание живота, его спазмы и боли, атопический дерматит.
Диагностика. Диагноз ферментативной недостаточности ставится на основании анамнеза, симптомов заболевания и анализа кала. Основы лечения. Использование препаратов, содержащих соответствующие ферменты, снижение в рационе содержания молока или продуктов с добавлением сахара в зависимости от типа непереносимого углевода.
Поскольку в кишечнике всасываются все поступающие с пищей моносахариды (фруктоза, галактоза, манноза и т.п.), то перед организмом встает задача превратить полученные гексозы в глюкозу для ее дальнейшего использования в реакциях метаболизма. Этот процесс получил название взаимопревращение сахаров (унификация моносахаридов).Цель этого процеса – создание только одного субстрата для реакций метаболизма, а именно α-D-глюкозы, что позволяет сэкономить ресурсы, не образовывать множество ферментов для каждого вида моносахарида. Реакции протекают в эпителии кишечника и, в основном, в гепатоцитах.
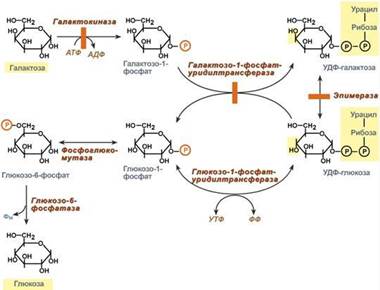 Превращение галактозы.Галактоза сначала подвергается фосфорилированию по 1-му атому углерода. Отличительной особенностью является превращение в глюкозу не напрямую, а через синтез УДФ-галактозы из галактозо-1-фосфата. Источником УМФ является УДФ-глюкоза, заранее имеющаяся в клетке. Образованная УДФ-галактоза впоследствии изомеризуется в УДФ-глюкозу и далее ее судьба различна.Она может: -участвовать в реакции переноса УМФ на галактозо-1-фосфат, -превращаться в свободную глюкозу и выходить в кровь, -отправляться на синтез гликогена. Нарушения обмена галактозы могут быть вызваны генетическим дефектом одного из ферментов: галактокиназы, галактозо-1-фосфат-уридилтрансферазы, эпимеразы. Заболевание, возникающее при этих нарушениях, получило название галактоземия.
Превращение галактозы.Галактоза сначала подвергается фосфорилированию по 1-му атому углерода. Отличительной особенностью является превращение в глюкозу не напрямую, а через синтез УДФ-галактозы из галактозо-1-фосфата. Источником УМФ является УДФ-глюкоза, заранее имеющаяся в клетке. Образованная УДФ-галактоза впоследствии изомеризуется в УДФ-глюкозу и далее ее судьба различна.Она может: -участвовать в реакции переноса УМФ на галактозо-1-фосфат, -превращаться в свободную глюкозу и выходить в кровь, -отправляться на синтез гликогена. Нарушения обмена галактозы могут быть вызваны генетическим дефектом одного из ферментов: галактокиназы, галактозо-1-фосфат-уридилтрансферазы, эпимеразы. Заболевание, возникающее при этих нарушениях, получило название галактоземия.
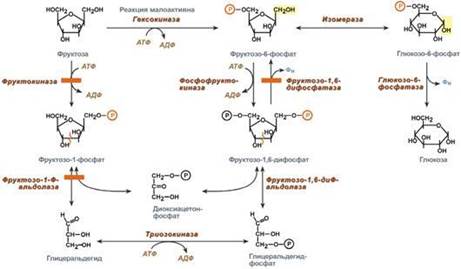 Превращение фруктозы.Переход фруктозы в глюкозу осуществляется по двум направлениям. Сначала происходит активация фруктозы посредством фосфорилирования либо 6-го атома углерода при участии гексокиназы, либо 1-го атома при участии фруктокиназы. Но гексокиназа имеет гораздо более низкое сродство к фруктозе и этот путь не выражен. Фруктозо-6-фосфат далее изомеризуется и глюкозо-6-фосфатаза отщепляет уже ненужный фосфат.Если образуется фруктозо-1-фосфат, под действием соответствующей альдолазы он превращается в глицеральдегид и диоксиацетонфосфат, которые в дальнейших реакциях либо используются в гликолизе, либо в реакциях глюконеогенеза превращаются в фруктозо-6-фосфат и далее в глюкозу. Особенностью метаболизма фруктозы является то, что фермент фруктокиназа является инсулин-независимым. В результате превращение фруктозы в пировиноградную кислоту и ацетил-SКоА происходит быстрее, чем для глюкозы. Это объясняется "игнорированием" лимитирующей реакции метаболизма глюкозы, катализируемой фосфофруктокиназой. Дальнейший метаболизм ацетил-SКоА в данном случае может привести к избыточному образованию жирных кислот и триацилглицеролов. Генетический дефект фруктокиназы приводит к доброкачественной эссенциальной фруктозурии, протекающей безо всяких отрицательных симптомов. Наследственная фруктозурия. Заболевание формируется вследствие наследственных аутосомно-рецессивных дефектов других ферментов обмена фруктозы. Дефект фруктозо-1-фосфатальдолазы проявляется после введения в рацион младенца соков и фруктов, содержащих фруктозу.
Превращение фруктозы.Переход фруктозы в глюкозу осуществляется по двум направлениям. Сначала происходит активация фруктозы посредством фосфорилирования либо 6-го атома углерода при участии гексокиназы, либо 1-го атома при участии фруктокиназы. Но гексокиназа имеет гораздо более низкое сродство к фруктозе и этот путь не выражен. Фруктозо-6-фосфат далее изомеризуется и глюкозо-6-фосфатаза отщепляет уже ненужный фосфат.Если образуется фруктозо-1-фосфат, под действием соответствующей альдолазы он превращается в глицеральдегид и диоксиацетонфосфат, которые в дальнейших реакциях либо используются в гликолизе, либо в реакциях глюконеогенеза превращаются в фруктозо-6-фосфат и далее в глюкозу. Особенностью метаболизма фруктозы является то, что фермент фруктокиназа является инсулин-независимым. В результате превращение фруктозы в пировиноградную кислоту и ацетил-SКоА происходит быстрее, чем для глюкозы. Это объясняется "игнорированием" лимитирующей реакции метаболизма глюкозы, катализируемой фосфофруктокиназой. Дальнейший метаболизм ацетил-SКоА в данном случае может привести к избыточному образованию жирных кислот и триацилглицеролов. Генетический дефект фруктокиназы приводит к доброкачественной эссенциальной фруктозурии, протекающей безо всяких отрицательных симптомов. Наследственная фруктозурия. Заболевание формируется вследствие наследственных аутосомно-рецессивных дефектов других ферментов обмена фруктозы. Дефект фруктозо-1-фосфатальдолазы проявляется после введения в рацион младенца соков и фруктов, содержащих фруктозу.
Роль печени: 1. В гепатоцитах активно протекают процессы углеводного обмена. Благодаря синтезу и распаду гликогена печень поддерживает концентрацию глюкозы в крови. Запасы гликогена в печени составляют от 30 до 100 г. При кратковременном голодании происходит гликогенолиз, в случае длительного голодания основным источником глюкозы крови является глюконеогенез из АК и глицерина. 2. Печень осуществляет взаимопревращение сахаров, т.е. превращение гексоз (фруктозы, галактозы) в глюкозу. 3. Активные реакции пентозофосфатного пути обеспечивают наработку НАДФН, необходимого для микросомального окисления и синтеза жирных кислот и холестерола из глюкозы.
15. Биосинтез и мобилизация гликогена: последовательность реакций, физио- логическое значение. Регуляция обмена гликогена. Гликогенозы и агликогенозы.
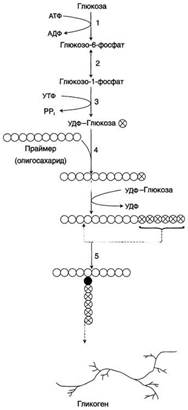
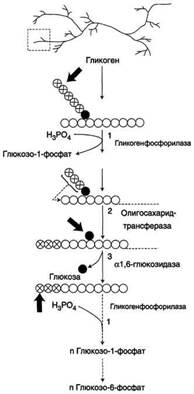 Гликоген- разветвлённый гомополимер глюкозы, в котором остатки глюкозы соединены в линейных участках α-1,4-гликозидной связью. В точках ветвления мономеры соединены α-1,6-гликозидными связями. Эти связи образуются примерно с каждым десятым остатком глюкозы. Гликоген синтезируется в период пищеварения (через 1-2 ч после приёма углеводной пищи). Следует отметить, что синтезгликогена из глюкозы, как и любой анаболический процесс, является эндергоническим, т.е. требующим затрат энергии. Глюкоза, поступающая в клетку, фосфорилируется при участии АТФ (реакция 1). Затем глюкозо-6-фосфат в ходе обратимой реакции превращается в глюкозо-1 -фосфат (реакция 2) под действием фермента фосфоглюкомутазы. Глюкозо-1-фосфат по термодинамическому состоянию мог бы служить субстратом для синтеза гликогена. Но в силу обратимости реакции глюкозо-6-фосфат ↔ глюкозо-1-фосфат синтез гликогена из глюкозо-1-фосфата и его распад оказались бы также обратимыми и поэтому неконтролируемыми. Чтобы синтез гликогена был термодинамически необратимым, необходима дополнительная стадия образования уридинди-фосфатглюкозы из УТФ и глюкозо-1-фосфата (реакция 3). Фермент, катализирующий эту реакцию, назван по обратной реакции: УДФ-глюкопирофосфорилаза. Однако в клетке обратная реакция не протекает, потому что образовавшийся в ходе прямой реакции пирофосфат очень быстро расщепляется пирофосфатазой на 2 молекулы фосфата. Реакция образования УДФ-глюкозы обусловливает необратимость всей серии реакций, протекающих при синтезе гликогена. Образованная УДФ-глюкоза далее используется как донор остатка глюкозы при синтезе гликогена. Эту реакцию катализирует фермент гликогенсинтаза (глюкозилтрансфераза). Поскольку в данной реакции не используется АТФ, фермент называют синтазой, а не синтетазой. Так как гликоген в клетке никогда не расщепляется полностью, синтез гликогена осуществляется путём удлинения уже имеющейся молекулы полисахарида, называемой "затравка", или "праймер". К "затравке" последовательно присоединяются молекулы глюкозы. Строением молекулы "затравки" как бы предопределяется тип связи, который возникает в реакции трансгли-козилирования. Таким образом, синтезируется полисахарид, аналогичный по строению с "затравочным". В состав "затравки" может входить белок гликогенин, в котором к ОН-группе одного из тирозиновых остатков присоединена олигосахаридная цепочка (примерно 8 остатков глюкозы). Глюкозные остатки переносятся гликогенсинтазой на нередуцирующий конец олигосахарида и связываются α-1,4-гликозидными связями. По окончании синтеза гликогенин остаётся включённым в гранулу гликогена. Разветвлённая структура гликогена образуется при участии амило-1,4 →1,6-глюкозилтрансферазы, называемой ферментом "ветвления". Как только гликогенсинтаза удлиняет линейный участок примерно до 11 глюкозных остатков, фермент ветвления переносит её концевой блок, содержащий 6-7 остатков, на внутренний остаток глюкозы этой или другой цепи. В точке ветвления концевой остаток глюкозы олигосахарида соединяется с гидроксильной группой в С6 положении с образованием α-1,6-гликозидной связи. Новая точка ветвления может быть образована на расстоянии не менее 4 остатков от любой уже существующей. Таким образом, по мере синтеза гликогена многократно возрастает число ветвлений. Концы цепей служат точками роста молекулы при её синтезе и началом при её распаде. Распад гликогена или его мобилизация происходят в ответ на повышение потребности организма в глюкозе. Гликоген печени распадается в основном в интервалах между приёмами пищи, кроме того, этот процесс в печени и мышцах ускоряется во время физической работы. Распад гликогена происходит путём последовательного отщепления остатков глюкозы в виде глюкозо-1-фосфата. Гликозидная связь расщепляется с использованием неорганического фосфата, поэтому процесс называется фосфоролизом, а фермент гликогенфосфорилазой. Гликогенфосфорилаза расщепляет только α-1,4-гликозидные связи (реакция 1). Последовательное отщепление глюкозных остатков прекращается, когда до точки ветвления остаётся 4 мономера. Дальнейший распад гликогена требует участия двух других ферментов. Сначала три оставшихся до точки ветвлении глюкозных остатка переносятся при участии олигосахаридтрансферазы (реакция 2) на нередуцирующий конец соседней цепи, удлиняя её и таким образом создавая условия для действия фосфорилазы. Оставшийся в точке ветвления глюкозный остаток гидролитически отщепляется с помощью α-1,6-глюкозидазы в виде свободной глюкозы (реакция 3), после чего неразветвлённый участок гликогена может вновь атаковаться фосфорилазой. Перенос 3х остатков глюкозы и удаление мономера из точки ветвления (реакции 2 и 3) катализирует один и тот же фермент, который обладает двумя разными ферментативными активностями - трансферазной и гликозидазной. Его называют "деветвящим" ферментом.
Гликоген- разветвлённый гомополимер глюкозы, в котором остатки глюкозы соединены в линейных участках α-1,4-гликозидной связью. В точках ветвления мономеры соединены α-1,6-гликозидными связями. Эти связи образуются примерно с каждым десятым остатком глюкозы. Гликоген синтезируется в период пищеварения (через 1-2 ч после приёма углеводной пищи). Следует отметить, что синтезгликогена из глюкозы, как и любой анаболический процесс, является эндергоническим, т.е. требующим затрат энергии. Глюкоза, поступающая в клетку, фосфорилируется при участии АТФ (реакция 1). Затем глюкозо-6-фосфат в ходе обратимой реакции превращается в глюкозо-1 -фосфат (реакция 2) под действием фермента фосфоглюкомутазы. Глюкозо-1-фосфат по термодинамическому состоянию мог бы служить субстратом для синтеза гликогена. Но в силу обратимости реакции глюкозо-6-фосфат ↔ глюкозо-1-фосфат синтез гликогена из глюкозо-1-фосфата и его распад оказались бы также обратимыми и поэтому неконтролируемыми. Чтобы синтез гликогена был термодинамически необратимым, необходима дополнительная стадия образования уридинди-фосфатглюкозы из УТФ и глюкозо-1-фосфата (реакция 3). Фермент, катализирующий эту реакцию, назван по обратной реакции: УДФ-глюкопирофосфорилаза. Однако в клетке обратная реакция не протекает, потому что образовавшийся в ходе прямой реакции пирофосфат очень быстро расщепляется пирофосфатазой на 2 молекулы фосфата. Реакция образования УДФ-глюкозы обусловливает необратимость всей серии реакций, протекающих при синтезе гликогена. Образованная УДФ-глюкоза далее используется как донор остатка глюкозы при синтезе гликогена. Эту реакцию катализирует фермент гликогенсинтаза (глюкозилтрансфераза). Поскольку в данной реакции не используется АТФ, фермент называют синтазой, а не синтетазой. Так как гликоген в клетке никогда не расщепляется полностью, синтез гликогена осуществляется путём удлинения уже имеющейся молекулы полисахарида, называемой "затравка", или "праймер". К "затравке" последовательно присоединяются молекулы глюкозы. Строением молекулы "затравки" как бы предопределяется тип связи, который возникает в реакции трансгли-козилирования. Таким образом, синтезируется полисахарид, аналогичный по строению с "затравочным". В состав "затравки" может входить белок гликогенин, в котором к ОН-группе одного из тирозиновых остатков присоединена олигосахаридная цепочка (примерно 8 остатков глюкозы). Глюкозные остатки переносятся гликогенсинтазой на нередуцирующий конец олигосахарида и связываются α-1,4-гликозидными связями. По окончании синтеза гликогенин остаётся включённым в гранулу гликогена. Разветвлённая структура гликогена образуется при участии амило-1,4 →1,6-глюкозилтрансферазы, называемой ферментом "ветвления". Как только гликогенсинтаза удлиняет линейный участок примерно до 11 глюкозных остатков, фермент ветвления переносит её концевой блок, содержащий 6-7 остатков, на внутренний остаток глюкозы этой или другой цепи. В точке ветвления концевой остаток глюкозы олигосахарида соединяется с гидроксильной группой в С6 положении с образованием α-1,6-гликозидной связи. Новая точка ветвления может быть образована на расстоянии не менее 4 остатков от любой уже существующей. Таким образом, по мере синтеза гликогена многократно возрастает число ветвлений. Концы цепей служат точками роста молекулы при её синтезе и началом при её распаде. Распад гликогена или его мобилизация происходят в ответ на повышение потребности организма в глюкозе. Гликоген печени распадается в основном в интервалах между приёмами пищи, кроме того, этот процесс в печени и мышцах ускоряется во время физической работы. Распад гликогена происходит путём последовательного отщепления остатков глюкозы в виде глюкозо-1-фосфата. Гликозидная связь расщепляется с использованием неорганического фосфата, поэтому процесс называется фосфоролизом, а фермент гликогенфосфорилазой. Гликогенфосфорилаза расщепляет только α-1,4-гликозидные связи (реакция 1). Последовательное отщепление глюкозных остатков прекращается, когда до точки ветвления остаётся 4 мономера. Дальнейший распад гликогена требует участия двух других ферментов. Сначала три оставшихся до точки ветвлении глюкозных остатка переносятся при участии олигосахаридтрансферазы (реакция 2) на нередуцирующий конец соседней цепи, удлиняя её и таким образом создавая условия для действия фосфорилазы. Оставшийся в точке ветвления глюкозный остаток гидролитически отщепляется с помощью α-1,6-глюкозидазы в виде свободной глюкозы (реакция 3), после чего неразветвлённый участок гликогена может вновь атаковаться фосфорилазой. Перенос 3х остатков глюкозы и удаление мономера из точки ветвления (реакции 2 и 3) катализирует один и тот же фермент, который обладает двумя разными ферментативными активностями - трансферазной и гликозидазной. Его называют "деветвящим" ферментом.
Продукт действия гликогенфосфорилазы - глюкозо-1-фосфат - затем изомеризуется в глюкозо-6-фосфат фосфоглюкомутазой. Далее глюкозо-6-фосфат включается в процесс катаболизма или другие метаболические пути. В печени (но не в мышцах) глюкозо-6-фосфат может гидролизоваться с образованием глюкозы, которая выделяется в кровь. Эту реакцию катализирует фермент глюкозо-6-фосфатаза. Реакция протекает в просвете ЭР, куда с помощью специального белка транспортируется глюкозо-6-фосфат. Фермент локализован на мембране ЭР таким образом, что его активный центр обращён в просвет ЭР. Продукты гидролиза (глюкоза и неорганический фосфат) возвращаются в цитоплазму также с помощью транспортных систем.
Биологическое значение: *синтез и распад гликогена протекают по разным метаболическими путям;
*печень запасает глюкозу в виде гликогена не столько для собственных нужд, сколько для поддержания постоянной концентрации глюкозы в крови, и, следовательно, обеспечивает поступление глюкозы в другие ткани. Присутствие в печени глюкозо-6-фосфатазы обусловливает эту главную функцию печени в обмене гликогена;
*функция мышечного гликогена заключается в освобождении глюкозо-6-фосфата, потребляемого в самой мышце для окисления и использования энергии;
*синтез гликогена - процесс эндергонический. Так на включение одного остатка глюкозы в полисахаридную цепь используется 1 моль АТФ и 1 моль УТФ;
*распад гликогена до глюкозо-6-фосфата не требует энергии;
*необратимость процессов синтеза и распада гликогена обеспечивается их регуляцией.
Метаболизм гликогена в печени, мышцах и других клетках регулируется несколькими гормонами, одни из которых активируют синтез гликогена, а другие – распад гликогена. При этом в одной клетке не могут идти одновременно синтез и распад гликогена – это противоположные процессы с совершенно с разными задачами. Синтез и распад исключают друг друга или, по-другому, они реципрокны.
Активность ключевых ферментов метаболизма гликогена гликогенфосфорилазы и гликогенсинтазы изменяется в зависимости наличия в составе фермента фосфорной кислоты – они активны либо в фосфорилированной, либо в дефосфорилированной форме. Присоединение фосфатов к ферменту производят протеинкиназы, источником фосфора является АТФ: -фосфорилаза гликогена активируется после присоединения фосфатной группы, -синтаза гликогена после присоединения фосфата инактивируется. Скорость фосфорилирования указанных ферментов повышается после воздействия на клетку адреналина, глюкагона и некоторых других гормонов. В результате адреналин и глюкагон вызывают гликогенолиз, активируя фосфорилазу гликогена.
Например, во время мышечной работы адреналин вызывает фосфорилирование внутримышечных ферментов обмена гликогена. В результате фосфорилаза гликогена активируется, синтаза инактивируется. В мышце происходит распад гликогена, образуется глюкоза для обеспечения энергией мышечного сокращения. При голодании в ответ на снижение глюкозы крови из поджелудочной железы секретируется глюкагон. Он воздействует на гепатоциты и вызывает фосфорилирование ферментов обмена гликогена, что приводит к гликогенолизу и повышению глюкозы в крови.
Способы активации синтазы гликогена.Гликогенсинтаза при присоединении фосфата прекращает работу, т.е. она активна в дефосфорилированном виде. Удаление фосфата от ферментов осуществляют протеинфосфатазы. Активатором протеинфосфатаз выступает инсулин – в результате он повышает синтез гликогена. Вместе с этим, инсулин и глюкокортикоиды ускоряют синтез гликогена, увеличивая количество молекул гликогенсинтазы.
Способы активации фосфорилазы гликогена. Скорость гликогенолиза лимитируется только скоростью работы фосфорилазы гликогена. Ее активность может изменяться тремя способами: •ковалентная модификация, •кальций-зависимая активация и •аллостерическая активация с помощью АМФ.
Ковалентная модификация фосфорилазы
При действии некоторых гормонов на клетку происходит активация фермента через аденилатциклазный механизм, который является так называемым каскадным регулированием. Последовательность событий в данном механизме включает: 1. Молекула гормона (адреналин, глюкагон) взаимодействует со своим рецептором;
2. Активный гормон-рецепторный комплекс воздействует на мембранный G-‑белок;
3. G-белок активирует фермент аденилатциклазу;
4. Аденилатциклаза превращает АТФ в циклический АМФ (цАМФ) – вторичный посредник (мессенджер);
5. цАМФ аллостерически активирует фермент протеинкиназу А;
6. Протеинкиназа А фосфорилирует различные внутриклеточные белки:
-одним из этих белков является синтаза гликогена, ее активность угнетается,
-другим белком – киназа фосфорилазы, которая при фосфорилировании активируется;
7. Киназа фосфорилазы фосфорилирует фосфорилазу "b" гликогена, последняя в результате превращается в активную фосфорилазу "а";
8. Активная фосфорилаза "а" гликогена расщепляет α-1,4-гликозидные связи в гликогене с образованием глюкозо-1-фосфата.
Кроме гормонов, влияющих на активность аденилатциклазы через G-белки, существуют иные способы регуляции этого механизма. Например, после воздействия инсулина активируется фермент фосфодиэстераза, которая гидролизует цАМФ и, следовательно, снижает активность гликоген-фосфорилазы.
Кальций-зависимая активация. Некоторые гормоны влияют на углеводный обмен посредством кальций-фосфолипидного механизма. Активация ионами кальция заключается в активации киназы фосфорилазы не протеинкиназой, а ионами Ca2+ и кальмодулином. Этот путь работает при инициации кальций-фосфолипидного механизма. Такой способ оправдывает себя, например, при мышечной нагрузке, если гормональные влияния через аденилатциклазу недостаточны, но в цитоплазму под влиянием нервных импульсов поступают ионы Ca2+.
Аллостерическая активация. Также существует активация фосфорилазы гликогена с помощью АМФ – аллостерическая активация благодаря присоединению АМФ к молекуле фосфорилазы "b". Способ работает в любой клетке – при увеличении расхода АТФ и накоплении продуктов его распада.
Гликогеновые болезни – это наследственные заболевания, обусловленные недостаточностью каких-либо ферментов, отвечающих за метаболизм гликогена. Могут быть нарушены обе стороны обмена: как синтез гликогена, так и его распад. В настоящее время гликогенозы делят по патогенетическому признаку на печеночные, мышечные и смешанные формы. Печеночные гликогенозы. Самый частый гликогеноз I типа или болезнь фон Гирке обусловлен аутосомно-рецессивным дефектом глюкозо-6-фосфатазы. Из-за того, что этот фермент есть только в печени и почках, преимущественно страдают эти органы, и болезнь носит еще одно название – гепаторенальный гликогеноз. Даже у новорожденных детей наблюдаются гепатомегалия и нефромегалия, обусловленные накоплением гликогена не только в цитоплазме, но и в ядрах клеток. Кроме этого, активируется синтез липидов с возникновением стеатоза печени. Так как фермент необходим для дефосфорилирования глюкозо-6-фосфата с последующим выходом глюкозы в кровь, у больных отмечается гипогликемия и, как следствие, ацетонемия, метаболический ацидоз, ацетонурия.Гликогеноз III типа или болезнь Форбса-Кори или лимит-декстриноз – это аутосомно-рецессивный дефект амило-α1,6-глюкозидазы, "деветвящего" фермента, гидролизующего α1,6-гликозидную связь. Болезнь имеет более доброкачественное течение, и частота ее составляет примерно 25% от всех гликогенозов. Для больных характерна гепатомегалия, умеренная задержка физического развития, в подростковом возрасте возможна небольшая миопатия.Гликогеноз IV типа (болезнь Андерсена), связанный с дефектом ветвящего фермента и гликогеноз VI типа (болезнь Херса), связанный с дефицитом печеночной фосфорилазы гликогена встречаются довольно редко. Мышечные гликогенозы. Для этой группы гликогенозов характерны изменения ферментов мышечной ткани. Это приводит к нарушению энергообеспечения мышц при физической нагрузке, к болям в мышцах, судорогам. Гликогеноз V типа (болезнь Мак-Ардля) – отсутствие мышечной фосфорилазы. При тяжелой мышечной нагрузке возникают судороги, миоглобинурия, хотя легкая работа не вызывает каких-либо проблем. Смешанные гликогенозы. Эти заболевания касаются и печени, и мышц, и других органов. Гликогеноз II типа (болезнь Помпе) – поражаются все гликогенсодержащие клетки из-за отсутствия лизосомальной α-1,4-глюкозидазы, поэтому данная болезнь относится к лизосомным болезням накопления. Происходит накопление гликогена в лизосомах и в цитоплазме. Заболевание составляет почти 10% всех гликогенозов и является наиболее злокачественным. Больные умирают в грудном возрасте из-за кардиомегалии и тяжелой сердечной недостаточности.
Агликогенозы – состояния, связанные с отсутствием гликогена. В качестве примера агликогеноза можно привести наследственный аутосомно-рецессивный дефицит гликоген-синтазы. Симптомами является резкая гипогликемия натощак, особенно утром, появляется рвота, судороги, потеря сознания. В результате гипогликемии наблюдается задержка психомоторного развития, умственная отсталость. Болезнь несмертельна при адекватном лечении (частое кормление), хотя и опасна.
 16. Анаэробный распад глюкозы: последовательность реакций, физиологическое значение. Роль анаэробного распада глюкозы в мышцах. Дальнейшая судьба молочной кислоты.
16. Анаэробный распад глюкозы: последовательность реакций, физиологическое значение. Роль анаэробного распада глюкозы в мышцах. Дальнейшая судьба молочной кислоты.
В анаэробном процессе пировиноградная кислота восстанавливается до молочной кислоты (лактата), поэтому в микробиологии анаэробный гликолиз называют молочнокислым брожением. Лактат является метаболическим тупиком и далее ни во что не превращается, единственная возможность утилизовать лактат – это окислить его обратно в пируват. Многие клетки организма способны к анаэробному окислению глюкозы. Для эритроцитов он является единственным источником энергии. Клетки скелетной мускулатуры за счет бескислородного расщепления глюкозы способны выполнять мощную, быструю, интенсивную работу, как, например, бег на короткие дистанции, напряжение в силовых видах спорта. Бескислородное окисление глюкозы усиливается при гипоксии клеток при анемиях, нарушении кровообращения в тканях.Гликолиз. Анаэробное превращение глюкозы локализуется в цитозоле и включает два этапа из 11 ферментативных реакций.
Первый этап гликолиза – подготовительный, здесь происходит затрата энергии АТФ, активация глюкозы и образование из нее триозофосфатов.
Первая реакция гликолиза сводится к превращению глюкозы в реакционно-способное соединение за счет фосфорилирования 6-го, не включенного в кольцо, атома углерода. Эта реакция является первой в любом превращении глюкозы, катализируется гексокиназой.
Вторая реакция необходима для выведения еще одного атома углерода из кольца для его последующего фосфорилирования (фермент изомераза). В результате образуется фруктозо-6-фосфат.
Третья реакция – фермент фосфофруктокиназа фосфорилирует фруктозо-6-фосфат с образованием почти симметричной молекулы фруктозо-1,6-дифосфата. Эта реакция является главной в регуляции скорости гликолиза.
В четвертой реакции фруктозо-1,6-дифосфат разрезается пополам фруктозо-1,6-дифосфат-альдолазой с образованием двух фосфорилированных триоз-изомеров – альдозы глицеральдегида (ГАФ) и кетозы диоксиацетона (ДАФ).
Пятая реакция – переход глицеральдегидфосфата и диоксиацетонфосфата друг в друга при участии триозофосфатизомеразы. Равновесие реакции сдвинуто в пользу диоксиацетонфосфата, его доля составляет 97%, доля глицеральдегидфосфата – 3%. Эта реакция, при всей ее простоте, определяет дальнейшую судьбу глюкозы:
при нехватке энергии в клетке и активации окисления глюкозы диоксиацетонфосфат превращается в глицеральдегидфосфат, который далее окисляется на втором этапе гликолиза, при достаточном количестве АТФ, наоборот, глицеральдегидфосфат изомеризуется в диоксиацетонфосфат, и последний отправляется на синтез жиров.
Второй этап гликолиза – это освобождение энергии, содержащейся в глицеральдегидфосфате, и запасание ее в форме АТФ.
Шестая реакция гликолиза (фермент глицеральдегидфосфат-дегидрогеназа) – окисление глицеральдегидфосфата и присоединение к нему фосфорной кислоты приводит к образованию макроэргического соединения 1,3-дифосфоглицериновой кислоты и НАДН.
В седьмой реакции (фермент фосфоглицераткиназа) энергия фосфоэфирной связи, заключенная в 1,3-дифосфоглицерате тратится на образование АТФ. Реакция получила дополнительное название – реакция субстратного фосфорилирования, что уточняет источник энергии для получения макроэргической связи в АТФ (от субстрата реакции) в отличие от окислительного фосфорилирования (от электрохимического градиента ионов водорода на мембране митохондрий).
Восьмая реакция – синтезированный в предыдущей реакции 3-фосфоглицерат под влиянием фосфоглицератмутазы изомеризуется в 2-фосфоглицерат.
Девятая реакция – фермент енолаза отрывает молекулу воды от 2-фосфоглицериновой кислоты и приводит к образованию макроэргической фосфоэфирной связи в составе фосфоенолпирувата.
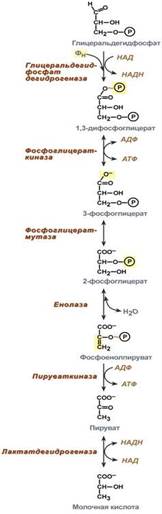 Десятая реакция гликолиза – еще одна реакция субстратного фосфорилирования – заключается в переносе пируваткиназой макроэргического фосфата с фосфоенолпирувата на АДФ и образовании пировиноградной кислоты.
Десятая реакция гликолиза – еще одна реакция субстратного фосфорилирования – заключается в переносе пируваткиназой макроэргического фосфата с фосфоенолпирувата на АДФ и образовании пировиноградной кислоты.
 Реакция одиннадцатая – образование молочной кислоты из пирувата под действием лактатдегидрогеназы. Важно то, что эта реакция осуществляется только в анаэробных условиях. Эта реакция необходима клетке, так как НАДН, образующийся в 6-й реакции, в отсутствие кислорода не может окисляться в митохондриях.
Реакция одиннадцатая – образование молочной кислоты из пирувата под действием лактатдегидрогеназы. Важно то, что эта реакция осуществляется только в анаэробных условиях. Эта реакция необходима клетке, так как НАДН, образующийся в 6-й реакции, в отсутствие кислорода не может окисляться в митохондриях.
При наличии кислорода пировиноградная кислота переходит в митохондрию и превращается в ацетил-S-КоА.
Для стабильного протекания гликолиза в бескислородных условиях необходимы ряд простых условий:-поступление глюкозы, -наличие минимальных количеств АТФ для активации процесса на первом этапе и АДФ как акцептора для фосфатов на втором этапе, -пополнение запасов окисленного НАД для шестой реакции. Если первые два условия подразумеваются сами собой, то для решения третьего условия существует специальное решение: в анаэробных условиях образуемый в шестой, глицеральдегидфосфат-дегидрогеназной реакции, НАДН используется в одиннадцатой реакции для восстановления пирувата до лактата. Образуемый таким образом НАД опять возвращается в шестую реакцию. Следовательно, клетке не нужны дополнительные источники НАД и дополнительные способы уборки НАДН! Процесс поддерживается самостоятельно. Процесс циклического восстановления и окисления НАД в реакциях анаэробного окисления глюкозы получил название гликолитическая оксидоредукция. В аэробных условиях гликолитической оксидоредукции не происходит, НАДН отдает свои атомы водорода на челночные системы для их передачи в дыхательную цепь митохондрий.
Для расчета количества АТФ, образованной при окислении глюкозы необходимо учитывать:
1. Реакции, идущие с затратой или образованием АТФ и ГТФ,
2. Реакции, продуцирующие НАДН и ФАДН2 и использующие их,
3. Так как глюкоза образует две триозы, то все соединения, образующиеся ниже ГАФ-дегидрогеназной реакции, образуются в двойном (относительно глюкозы) количестве.
Расчет АТФ при анаэробном окислении.На подготовительном этапе на активацию глюкозы затрачивается 2 молекулы АТФ, фосфат каждой из которых оказывается на триозе – глицеральдегидфосфате и диоксиацетонфосфате.В следующий второй этап входят две молекулы глицеральдегидфосфата, каждая из которых окисляется до пирувата с образованием 2-х молекул АТФ в седьмой и десятой реакциях – реакциях субстратного фосфорилирования. Таким образом, суммируя, получаем, что на пути от глюкозы до пирувата в чистом виде образуется 2 молекулы АТФ. Однако надо иметь в виду и пятую, глицеральдегидфосфат-дегидрогеназную, реакцию, из которой выходит НАДН. Если условия анаэробные, то он используется в лактатдегидрогеназной реакции, где окисляется для образования лактата и в получении АТФ не участвует.
В анаэробных условиях большое количество пировиноградной кислоты превращается в молочную кислоту, которая легко диффундирует во внеклеточное пространство и даже внутрь некоторых менее активных клеток. Следовательно, молочная кислота представляет собой разновидность «водосточного колодца», в котором исчезают конечные продукты гликолиза, что позволяет гликолизу осуществляться дольше, чем это могло быть при отсутствии молочной кислоты.Большое количество молочной кислоты, которое образуется во время анаэробного гликолиза, не теряется организмом, т.к. если кислород вновь становится доступным, молочная кислота может подвергнуться обратному превращению в глюкозу или напрямую использоваться для получения энергии. Большая часть этих превращений осуществляется в печени, но в небольших количествах может происходить и в других тканях. Если кислород вновь становится доступным после периода анаэробного метаболизма, молочная кислота быстро превращается в пировиноградную кислоту, НАД-Н и Н+. Большие количества этих веществ немедленно окисляются, образуя значительное количество АТФ. Избыток АТФ может явиться причиной того, что более 75% пировиноградной кислоты вновь превращается в глюкозу. Сердечная мышца обладает способностью превращать молочную кислоту в пировиноградную и затем использовать последнюю для получения энергии. В большинстве случаев это происходит при больших физических нагрузках, когда в кровь поступают значительное количество молочной кислоты из скелетных мышц и суммарно дает существенное количество энергии сердечной мышце.
Эффе
Дата добавления: 2015-07-24; просмотров: 1659;
