Ферменты понижают энергию активации химической реакции
1) Как и любые катализаторы, ферменты повышают скорость химической реакции за счёт снижения энергии активации реакции (энергетического барьера) реакции.
2) Снижение энергии активации при ферментативном катализе обусловлено увеличением числа стадий химического процесса.
Индуцирование рядапромежуточных стадий приводит к тому, что исходный барьер энергии активации (Еа) дробится на несколько более низких барьеров энергии активации, преодолеть которые реагирующие молекулы могут гораздо быстрее, чем основной.
3) Ферменты помогают субстратам принять переходное состояние за счет энергии связывания при образовании фермент-субстратного комплекса. Так, при образовании водородных связей между субстратом и ферментом при фиксации субстрата на поверхности фермента выделяется энергия (Еа), которая затрачивается на перевод молекул субстрата в активное состояние.
Условная запись реакции образования и функционирования фермент-субстратного комплекса выглядит следующим образом:
E + S ↔ ES → EP → E + P
При взаимодействии фермента с субстратом можно выделить три стадии:
1. Первая стадия: образование фермент-субстратного комплекса,
т. е. присоединение субстрата к макромолекуле фермента.
2. Вторая стадия: непосредственно ферментативная реакция.
3. Третья стадия: отделение продуктов превращения субстрата от фермента.
Первая стадия - образование фермент-субстратного комплекса
(E + S ↔ ES):
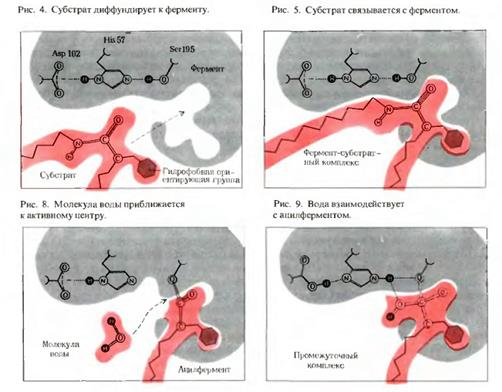
1) Взаимодействию фермента с субстратом предшествует сближение и ориентация субстрата по отношению к активному центру фермента.
2)Затем образуются фермент-субстратные (ES) комплексы.
Тонкий механизм формирования фермент-субстратного комплекса:
а) при формировании фермент-субстратного комплекса обратимо меняется третичная структура (конформация) фермента, что способствует наилучшему пространственному соответствию молекул фермента и субстрата (рис. 3.5):
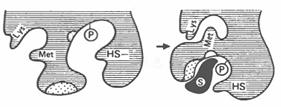
Рис. 3.5. Схематическое изображение конформационных изменений в ферменте, индуцированных субстратом.
б) взаимодействие фермента с субстратом вызывает локальное конформационное изменение некоторых сайтов белковой макромолекулы фермента (Рис. 3.6):
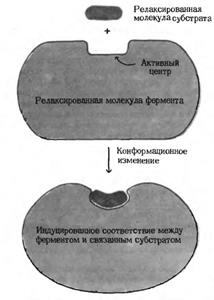
Рис. 3.6. Индуцированное соответствие между активным центром фермента и напряженной формой молекулы субстрата
в) в результате чего комплементарность его активного центра к субстрату резко повышается и обеспечивает возможность осуществления каталитического процесса.
Вторая стадия – непосредственно ферментативная реакция.
а) ускорение реакции достигается за счёт двух факторов:
- сближения и правильной ориентации субстратов относительно друг друга;
- увеличения их эффективной концентрации (поскольку в растворе их концентрации случайны).
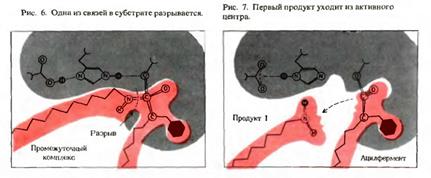
б) на этой стадии происходит химическая реакция через возникновение переходного состояния (EP) с образованием продукта реакции на поверхности фермента:
ES → EP
!!! На данной стадии фермент, в свою очередь, оказывает значительное влияние на субстрат.
а) под влиянием фермента структура субстрата изменяется: сначала образуется переходное состояние, а затем продукты (P) ферментативной реакции.
!!! Именно в этот момент (EP) происходит одновременный разрыв старых и образование новых связей.
б) субстрат вступает в промежуточные реакции с определёнными функциональными группами активного центра фермента, в результате чего реакция требует более низкой энергии активации.
в) при образовании фермент-субстратного комплекса происходит обмен электронами и протонами между ферментом и субстратом.
(1) Если фермент отдаёт электронную пару субстрату, т. е. фермент является донором электронов, осуществляющим нуклеофильную атаку, то имеет место нуклеофильный катализ.
(2) В электрофильном катализе, напротив, фермент принимает (акцептирует) пару электронов от субстрата, т. е. является акцептором электронной пары.
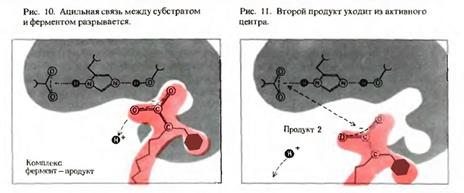
Третья стадия - отделение продуктов превращения субстрата от фермента.
На заключительной стадии фермент освобождается и вступает во взаимодействие с новыми молекулами субстрата, совершая множество «оборотов» данной химической реакции (EP → E + P):
Дата добавления: 2015-07-24; просмотров: 781;
