Металевий зв’язок

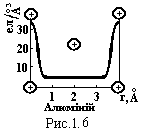 Металевий тип зв’язку виникає між атомами , у яких валентний електрон слабо зв’язаний з ядром. При зближенні атомів він покидає свій атом і може вільно переміщуватись по кристалу. Таким чином виникає досить однорідний розподіл густини від’ємного заряду, який різко зростає безпосередньо поблизу вузлів кристалічної гратки із-за наявності внутрішніх електронних оболонок. Наприклад, для алюмінію по результатам рентгенографічного аналізу ця залежність показана на рис.1.6. Зв’язок виникає за рахунок взаємодії позитивних іонів з електронним газом. Із зменшенням відстані між атомами збільшується густина електронного газу, що приводить до зростання сили зв’язку. Наряду з цим зростає сила кулонівського відштовхування ядер. При рівності цих сил утворюється стійка кристалічна гратка. Таким чином, металевий зв’язок подібний до ковалентного, оскільки в їхній основі лежить загальний принцип: узагальнення валентних електронів. Але якщо при ковалентному зв’язку узагальнені електрони знаходяться між сусідніми атомами, то в металах електрони не локалізуються біля своїх атомів, а вільно переміщуються по кристалу. Електронний газ виконує роль „цементу в бетоні”. У зв’язку з цим металевий зв’язок має ненаправлений характер і тому метали витримують досить значні пластичні деформації без руйнування.
Металевий тип зв’язку виникає між атомами , у яких валентний електрон слабо зв’язаний з ядром. При зближенні атомів він покидає свій атом і може вільно переміщуватись по кристалу. Таким чином виникає досить однорідний розподіл густини від’ємного заряду, який різко зростає безпосередньо поблизу вузлів кристалічної гратки із-за наявності внутрішніх електронних оболонок. Наприклад, для алюмінію по результатам рентгенографічного аналізу ця залежність показана на рис.1.6. Зв’язок виникає за рахунок взаємодії позитивних іонів з електронним газом. Із зменшенням відстані між атомами збільшується густина електронного газу, що приводить до зростання сили зв’язку. Наряду з цим зростає сила кулонівського відштовхування ядер. При рівності цих сил утворюється стійка кристалічна гратка. Таким чином, металевий зв’язок подібний до ковалентного, оскільки в їхній основі лежить загальний принцип: узагальнення валентних електронів. Але якщо при ковалентному зв’язку узагальнені електрони знаходяться між сусідніми атомами, то в металах електрони не локалізуються біля своїх атомів, а вільно переміщуються по кристалу. Електронний газ виконує роль „цементу в бетоні”. У зв’язку з цим металевий зв’язок має ненаправлений характер і тому метали витримують досить значні пластичні деформації без руйнування.
Дата добавления: 2015-07-24; просмотров: 921;
