Ковалентний зв’язок


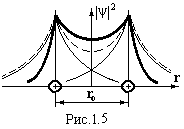
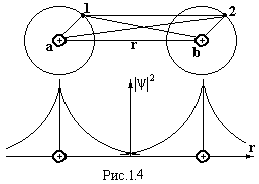 Ковалентний зв’язок виникає за рахунок обміну електронами сусідніх атомів. Такий тип сил зв’язку проявляється, наприклад, у молекулах Н2, О2, N2, в кристалах германію, кремнію, алмазу, тобто, як правило, між однаковими атомами. Розглянемо механізм виникнення сили зв’язку на прикладі молекули водню (рис.1.4). На великій відстані між атомами хвильові функції електронів сусідніх атомів майже не перекриваються. Кожний електрон належить своєму атому, тобто обмін електронами не відбувається. Наприклад, при відстані між ядрами r = 50 Å один обмін електронами може відбутися за 1012 років. Енергія такої системи дорівнює сумі енергій ізольованих атомів 2Ео. При зближенні атомів хвильові функції електронів перекриваються (рис.1.5), ймовірність їх переходів від атома до атома зростає настільки, що втрачає сенс вести мову про належність електрона певному атому. Наприклад, при ro = 2Å частота переходів електронів становить 1014 Гц. Практично пара електронів належить відразу обом атомам. При цьому відбувається не просте додавання ׀ψ׀2 (пунктирна лінія на рис.1.5), а затягування електронів у простір між ядрами (жирна лінія на рис.1.5). За межами цього простору густина електронної хмари зменшується порівняно з густиною в ізольованих атомах. Це приводить до зменшення енергії системи і до появи сили протягування між атомами. Ця узагальнена електронна пара як би стягує ядра, намагаючись їх зблизити. Енергія такої системи
Ковалентний зв’язок виникає за рахунок обміну електронами сусідніх атомів. Такий тип сил зв’язку проявляється, наприклад, у молекулах Н2, О2, N2, в кристалах германію, кремнію, алмазу, тобто, як правило, між однаковими атомами. Розглянемо механізм виникнення сили зв’язку на прикладі молекули водню (рис.1.4). На великій відстані між атомами хвильові функції електронів сусідніх атомів майже не перекриваються. Кожний електрон належить своєму атому, тобто обмін електронами не відбувається. Наприклад, при відстані між ядрами r = 50 Å один обмін електронами може відбутися за 1012 років. Енергія такої системи дорівнює сумі енергій ізольованих атомів 2Ео. При зближенні атомів хвильові функції електронів перекриваються (рис.1.5), ймовірність їх переходів від атома до атома зростає настільки, що втрачає сенс вести мову про належність електрона певному атому. Наприклад, при ro = 2Å частота переходів електронів становить 1014 Гц. Практично пара електронів належить відразу обом атомам. При цьому відбувається не просте додавання ׀ψ׀2 (пунктирна лінія на рис.1.5), а затягування електронів у простір між ядрами (жирна лінія на рис.1.5). За межами цього простору густина електронної хмари зменшується порівняно з густиною в ізольованих атомах. Це приводить до зменшення енергії системи і до появи сили протягування між атомами. Ця узагальнена електронна пара як би стягує ядра, намагаючись їх зблизити. Енергія такої системи
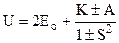 , (1.5)
, (1.5)
де К < 0 – енергія кулонівської взаємодії електронів з ядрами, електронів між собою і ядер між собою; А < 0 – енергія обмінної взаємодії, яка виникає за рахунок обміну електронами. Це як раз та додаткова енергія, що зумовлена перерозподілом густини електронної хмари; S – інтеграл неортогональності враховує зміну хвильових функцій під дією сусідніх атомів. Його величина лежить в межах від 0 до 1; Знак + у формулі (1.5) відповідає симетричному стану, коли спіни узагальнених електронів протилежні, а знак – антисиметричному стану при паралельних спінах узагальнених електронів.
Аналіз формули (1.5) показує, що для симетричного стану дріб завжди від’ємна і U < 2Ео. Виникає сила притягування. Для антисиметричного стану у випадку ковалентної природи сили зв’язку ׀А׀ >׀К׀ і тому U > 2Ео. Сила зв’язку не виникає. Але слід зауважити, що при ׀А׀ <׀К׀ U < 2Ео. Тобто теж виникає сила притягування. Такий випадок реалізується у феромагнетиках при обміні електронами внутрішніх незаповнених оболонок і приводить до утворення областей спонтанного намагнічування (доменів).
Особливістю ковалентної сили зв’язку є її направленість по лінії максимального перекриття хвильових функцій і насичений характер, тобто кожний атом утворює зв’язок з певною кількістю сусідніх атомів. Кількість утворюваних зв’язків визначається кількістю електронів, яких не вистачає для повного заповнення валентної електронної оболонки. Наприклад, для чотирьохвалентних германію і кремнію це по чотири сусідніх атомів, тому що для повного заповнення потрібно 8 електронів. Направленим характером зв’язку пояснюється крихкість кристалів, тому що пластичні деформації не виникають.
Дата добавления: 2015-07-24; просмотров: 948;
