Соединения
1. Оксиды и гидроксиды.
Оксид цинка белый, кадмия –коричневый, ртути ярко-красный, при при измельчение становится желтый. Желтая форма оксида ртути выделяется также при образование HgO в р-ре. В воде оксиды не р-римы, но в кислотах легко р-ряются.
При действие щелочи на соли Hg+2 выделяется высокодисперсный желтый осадок HgO.
Гидроксид цинка амфотерное основание; при взаимодействие со щелочью в р-ре образует гидроцинкаты (Na2[Zn(OH)4], Na4[Zn(OH)6]), при сплавление со щелочами цинкаты Na2ZnO2. амфотерные с-ва гидроксида кадмия выражены очень слабо, он лишь немного р-ряется в сильно конц р-рах щелочей. Гидроксид цинка и кадмия р-ряются в р-ре аммиака с образованием амминокомплексов:
M(OH)2 +4NH3 +2H2O = [M(NH3)4(H2O)2](ОН)2
Соли цинка и кадмия также образуют аммиакаты.
2. Для иона Hg2+ комплексные продукты присоединения NH3 не х-рны и образуются только в присутствии конц р-ров солей аммония. Гораздо типичнее для Hg2+ образование продуктов замещения водорода в аммиаке, которое легко идет при действие р-ра аммиака на различные соединения ртути:
2HgO +NH3 +H2O = [Hg2N]OH•2H2O –основание Миллона
Образование бурого осадка иодида основания Миллона является очень чувствительной р-цией обнаружения NH3 или NH4+, для этого обычно используют р-тив Несслера –щелочной р-р K2[HgI4]:
2K2[HgI4] + NH3 +3KOH =[Hg2N]I•H2O +7KI +2H2O
3. Цианиды металлов подгруппы цинка образуют комплексные соединения с цианидами ряда других металлов. Эти соединения большей частью р-римы в воде и отвечают формулам М2[Э(CN)4] и М[Э(CN)3].
4. своеобразная р-ция происходит при нагревании роданида ртути:
2Hg(SCN)2 = 2Hg + C3N4 + CS2
5. 2Hg2+ +2℮‾ = Hg22+ E○= +0.91 в
Hg22++ 2℮‾ = 2Hg○ Е○= +0.79 в
Вследствие близких значений потенциалов существует равновесие:
Hg22+ 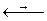 Hg2+ + Hg
Hg2+ + Hg
Дата добавления: 2015-07-24; просмотров: 1424;
