Подгруппа цинка
(цинк, кадмий, ртуть)
Электронная конфигурация основного состояния элементов подгруппы цинка отражается формулами
Zn: 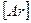 3d104s2
3d104s2
Cd: [Kr]4d105s2
Hg: [Xe]4f145d106s2
В образовании химических связей участвуют только внешние s-электроны, в соединениях элементы проявляют степень окисления +2. Для ртути известны соединения, в которых есть степень окисления +1, однако в них она всегда димеризована, поэтому формально ртуть двухвалентна. Катион Hg 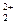
 образован по донорно-акцепторному механизму: Hg:)+□Hg2+à[Hg
образован по донорно-акцепторному механизму: Hg:)+□Hg2+à[Hg 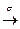 Hg]2+.
Hg]2+.
При движении по группе сверху вниз энергия ионизации атомов падает и уменьшается химическая активность (если цинк и кадмий стоят в электрохимическом ряду напряжений до водорода, то ртуть располагается за ним). В свободном состоянии элементы подгруппы цинка представляют собой белые металлы с синеватым (цинк) или с серебристым (кадмий, ртуть) оттенками. На влажном воздухе они покрываются оксидными пленками и теряют блеск. Все три металла, особенно ртуть, легкоплавки и довольно летучи. В противоположность ковкому и тягучему кадмию, цинк при обычных условиях обычно хрупок. Соединения цинка малоядовиты, растворимые соединения кадмия и ртути очень ядовиты.
Дата добавления: 2015-07-24; просмотров: 2076;
