Энзимодиагностика
развивается по двум путям:
1) использование ферментов в качестве избирательных реагентов для открытия и количественного определения нормальных или аномальных химических веществ в сыворотке крови, моче, желудочном соке и др. (например, выявление при помощи ферментов глюкозы, белка или других веществ в моче, в норме не обнаруживаемых).
2) открытие и количественное определение самих ферментов в биологических жидкостях при патологии. Оказалось, что ряд ферментов появляется в сыворотке крови при распаде клеток (отсюда их название «некротические ферменты»).
Для диагностики органических и функциональных поражений органов и тканей широко применяются отдельные ферментные тесты, выгодно отличающиеся от других химических диагностических тестов, используемых в клинике, высокой чувствительностью и специфичностью. Известно около 20 тестов, основанных на количественном определении активности ферментов (и изоферментов), главным образом в крови (реже в моче), а также в биоптатах (кусочки тканей, полученные при биопсии). В практическом плане энзимологические тесты должны помогать в ранней постановке и дифференциации диагноза, информировать о возможном исходе болезни и эффективности применяемой терапии. Теоретические аспекты медицинской энзимологии сводятся, в основном, к выяснению наиболее полной и достоверной картины патогенеза и этиологии заболевания, т.е. в конечном итоге к познанию молекулярных механизмов нарушений метаболических процессов.
При многих заболеваниях происходит повреждение клеток, и их содержимое, в том числе и ферменты, высвобождаются в кровь. К причинам, вызывающим высвобождение внутриклеточного содержимого в кровь, относят нарушение проницаемости мембраны клеток (при воспалительных процессах) или нарушение целостности клеток (при некрозе. Уровень активности ферментов в плазме коррелирует со степенью повреждения клеток.
Для энзимодиагностики имеют большое значение знания о субклеточной локализации ферментов:появление в плазме крови ферментов, имеющих только цитозольную локализацию, свидетельствует о воспалительном процессе; при обнаружении митохондриальных или ядерных ферментов можно говорить о более глубоких повреждениях клетки, например о некрозе.
Однако повышение концентрации ферментов не всегда связано с повреждением тканей. При избыточной клеточной пролиферации, например при онкопролиферативных процессах, при повышенной скорости синтеза некоторых ферментов в клетках наблюдают повышение концентрации в крови определённых ферментов. Врачам следует учитывать, что нормальные значения активности ферментов в крови детей и беременных женщин отличаются от показателей, характерных для взрослых здоровых людей.
Для правильной интерпретации результатов проведенных исследований обязательным является сопоставление энзимопоказателей с клинической картиной болезни в целом.При оценке выявленных нарушений необходима определенная осторожность, так как один и тот же энзиматический сдвиг может являться звеном патогенетической причинной цепи или характеризовать вторичные механизмы, сопутствующие данной форме патологии, или быть связанным со стереотипной, неспецифической реакцией организма на заболевание, такой, как реакция стресса.
В большинстве случаев клиницисты используют в энзимодиагностике комплекс прямых и косвенных методов исследования ферментов. Иногда появление в крови фермента, в норме в ней отсутствующего, позволяет сразу обнаружить поврежденный орган.Это возможно в том случае, когда фермент присутствует только в одном органе. Например, орнитинкарбомоилтрансферазанайдена только в печени. Однако таких высокоорганоспецифичных ферментов очень мало. Несколько больше ферментов, обнаруженных в двух органах или тканях. Большинство же ферментов широко распространены в организме, что затрудняет выяснение источника их происхождения.
Следует отметить, что из огромного числа ферментов (более 3500), открытых в природе (частично и в организме человека), в диагностической энзимологии используется лишь ограниченный набор ферментов и для весьма небольшого числа болезней (гепатиты, инфаркт миокарда, органические поражения почек, поджелудочной железы, печени и др.). Так, уровень липазы, амилазы, трипсина и химотрипсина в крови резко увеличен при сахарном диабете, злокачественных поражениях поджелудочной железы, болезнях печени и др. Резко повышается в сыворотке крови уровень двух аминотрансфераз, креатинкиназы (и ее изоферментов) и лактатдегидрогеназы (и ее изоферментов) при инфаркте миокарда; умеренно повышено их содержание при поражениях тканей мозга и печени. Определяют, кроме того, активность кислой фосфатазы (уровень повышен при карциноме предстательной железы), щелочной фосфатазы, холинэстеразы и других органоспецифических ферментов (например, гистидазы, глицинамидинотрансферазы, уроканиназы) в сыворотке крови при патологии костной ткани.
Использование изоферментов. При ряде заболеваний исследуют активность ЛДГ в плазме крови. В норме активность ЛДГ составляет
170-520 ЕД/л. Повышение активности наблюдают при острых поражениях сердца, печени, почек, а также при мегалобластных и гемолитических анемиях. Однако это указывает на повреждение лишь одной из перечисленных тканей. Для постановки диагноза необходимо исследование изоформ ЛДГ в плазме крови методом электрофореза. Выявление в плазме крови тканеспецифических изоформ ЛДГ используют в качестве диагностического теста повреждения данной ткани.
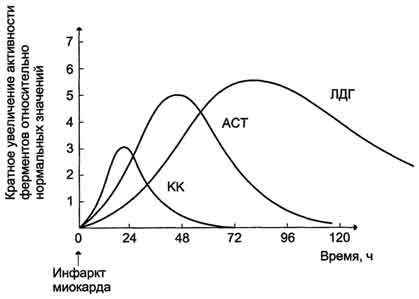
Активность КК в норме не должна превышать 90 МЕ/л. Определение активности КК в плазме крови имеет диагностическое значение при инфаркте миокарда (происходит повышение уровня МВ-изоформы). Количество изоформы ММ может повышаться при травмах и повреждениях скелетных мышц. Изоформа ВВ не может проникнуть через гематоэнцефалический барьер, поэтому в крови практически не определяется даже при инсультах и диагностического значения не имеет.
При инфаркте миокарда наблюдают достоверные изменения в крови активности ферментов КК, ЛДГ и аспартатаминотрансферазы - ACT, которые зависят от времени, прошедшего от начала развития инфаркта и от зоны тканевого повреждения. После закупорки (окклюзии) коронарного сосуда в крови вначале отмечают повышение активности КК изоформы MB, однако фермент быстро удаляется из кровотока. Активность ACT в норме составляет 5-40 МЕ/л. При инфаркте миокарда активность ACT повышается через 4-6 ч; максимум активности наблюдают в течение 2-3 дней. Уровень ЛДГ также увеличивается в плазме крови через несколько часов после закупорки кровеносного сосуда; максимум активности наблюдают на 3-4-й день, затей наступает постепенная нормализация активности. Уровень повышения активности ЛДГ коррелирует с размерами повреждения сердечной мышцы.
Дата добавления: 2015-07-24; просмотров: 3629;
