Закон Гесса. При химических реакциях имеют место качественные изменения в системе - исчезают одни вещества и образуются другие
При химических реакциях имеют место качественные изменения в системе - исчезают одни вещества и образуются другие. При этом происходит изменение внутренней энергии системы, которое может проявиться в виде теплоты или в виде работы. Работа расширения при химических процессах большей частью мала, а теплота может быть значительной, например, при сжигании газа или угля, при растворении концентрированной H2SO4 в воде, когда раствор быстро достигает точки кипения и т.д.
Практически каждый химический процесс сопровождается выделением или поглощением теплоты.
Изучением теплот химических реакций занимается определенный раздел химии - термохимия.
Первое начало термодинамики дает возможность рассчитать тепловой эффект химической реакции при различных условиях её проведения.
Химические уравнения, в которых наряду с химическими формулами веществ указаны тепловые эффекты реакций, называются термохимическими. Обычно термохимические уравнения, если это специально не оговорено, содержат тепловые эффекты реакций при постоянном давлении ∆H, а поскольку величина значений ∆H зависит от того, в каком агрегатном состоянии взяты реагенты, в термохимических уравнениях указывают их состояние буквами: (к) – кристаллическое или (тв) - твердое, (ж) – жидкое, (г) – газообразное. Кроме того, указывают модификацию вещества, например, С (графит), S (монокл) и т.п. Эти символы опускаются, если агрегатное состояние вещества очевидно.
Например, термохимическую реакцию окисления водорода в химической термодинамике записывают в виде
Н2(г) + 1/2 О2(г) ––> Н2О(ж) , ± ∆H.
Тепловой эффект относят к числу молей веществ, участвующих в реакции, в соответствии с их стехиометрическими коэффициентами.
Для данной реакции тепловой эффект ∆H (кДж) рассчитывают на 1 моль (2 г) водорода, 1/2 моль (16 г) кислорода или 1 моль (18 г) воды.
Взаимосвязь между ∆H и ∆U. Сопоставление уравнений Qp = ∆H и Qp = DU + рDV показывает, что разность между ∆H и DU определяется величиной работы расширения (сжатия):
∆H - DU = рDV.
Если в реакции участвуют вещества, находящиеся только в конденсированном состоянии (твердом или жидком), рDV – мало и ∆H @ DU.
Если в реакции участвуют газообразные вещества, а изменение числа молей этих веществ в ходе процесса равно ∆n, то, заменяя рDV на ∆nRT, получим
∆H - DU = ∆nRT,
где ∆n – изменение числа моль газообразных веществ.
С2Н2 (г)+ 5\2О2 (г) = Н2О(ж) + 2 СО2(г) ∆n = - 1,5 моль;
Cu(кр)+4HNO3(р) = 2NO2(г) + Cu(NO3)2(кр) +2 H2O(ж) ∆n = + 2,0 моль;
N2 (г) + 3H2 (г) = 2 NH3(г) ∆n = - 2,0 моль.
Если в реакции участвуют газообразные вещества, но число их молей в процессе не меняется (∆n = 0), то ∆H = DU.
Стандартная энтальпия образования вещества – это энтальпия реакции образования 1 моль сложного вещества из простых веществ, взятых в наиболее устойчивой модификации при 298 К и р = 105 Па (или 1 атм.).
Как указывалось, энтальпии образования простых веществ в наиболее устойчивых аллотропных формах принимаются равными нулю.
Рассмотрим энтальпии следующих реакций:
½ Н2(г) + ½ I2 (тв) = HI (г) ∆ H0298 = 26,04 кДж
Н2(г) + I2 (тв) = 2HI (г) ∆ H0298 = 52,08 кДж
Первое уравнение описывает процесс образования 1 моль HI(г) (∆H0298 обр HI), так как здесь водород и йод взяты в наиболее устойчивых агрегатных состояниях.
Во втором случае происходит образование двух молей HI, поэтому энтальпия этой реакции соответствует 2 (∆H0298 обр HI).
Рассмотрим следующие процессы:
Са (к) + 3/2 О2(г) + С(графит) = СаСО3(к)
СаО(к) + СО2(г) = СаСО3(к)
Первое уравнение описывает процесс образования 1 моль СаСО3(к) (∆H°298 обр СаСО3), так как здесь кальций и кислород взяты в наиболее устойчивых агрегатных состояниях при стандартных условиях и являются простыми веществами.
Энтальпия второй реакции не равна энтальпии образования, так как в данном случае образование 1 моль СаСО3 идет из сложных веществ СаО(к) и СО2(г).
Энтальпия сгорания вещества – энтальпия реакции окисления 1 моль вещества в избытке кислорода до высших устойчивых оксидов и Н2О(ж).
Например, тепловой эффект реакции:
С2Н2(г) + 5/2О2(г) = 2 СО2(г) + Н2О(ж)
соответствует энтальпии сгорания ∆H0сгор 1 моль ацетилена.
Основным законом термохимии является законГесса, являющийся частным случаем первого начала термодинамики.
Формулировка закона гласит: тепловой эффект химической реакции зависит только от природы, начального и конечного состояния веществ и не зависит от пути реакции.
Это значит, что если из данных веществ можно получить определенные продукты, проводя реакцию различными способами (различными путями), то, независимо от выбранного способа, тепловой эффект реакции будет одним и тем же.
Отсюда следует, что тепловой эффект химической реакции равен сумме тепловых эффектов всех ее промежуточных стадий.
С помощью закона Гесса можно рассчитывать тепловые эффекты реакций, которые недоступны для непосредственного измерения в калориметре (прибор для измерения тепловых эффектов). Например, теплоту образования СО из углерода и кислорода непосредственно измерить невозможно, так как часть углерода будет окисляться до СО2. DН0298 хр можно рассчитать по закону Гесса из следующих опытных данных:
С (графит) + О2(г) = СО2(г) DН0хр = -395 кДж;
СО (г) + ½ О2(г) = СО2(г) DН0хр = -284 кДж.
Вычитая из первого уравнения второе, получим:
С (графит) + ½ О2(г) = СО(г) DН0хр = -111 кДж.
Химические реакции, идущие с выделением теплоты, называются экзотермическими, а с поглощением тепла – эндотермическими.
Для определения энтальпий реакций пользуются 1-м и 2-м следствиями закона Гесса:
1-е следствие: Энтальпия химической реакции равна разности сумм энтальпий образования продуктов реакции и исходных веществ, умноженных на их стехиометрические коэффициенты.
DН0 298 хр = S (niDНº298 обр)прод - S (niDН°298обр)исх . (5)
Рассчитаем изменение энтальпии в ходе реакции при р = const.:
Cu(кр) + 4HNO3(р) = 2NO2(г) + Cu(NO3)2(кр) + 2 H2O(ж)
DН0298 обр
кДж/моль 0 -174 33 -305,3 -286
DН0298 хр= å(DН°298 обр )прод - å(DН°298 обр) исх = [2×33 + (-305) + 2(-286)] –
[4(-174) + 0] = -115 кДж
Видно, что DН°298 хр отрицательна (реакция экзотермическая), идет с выделением тепла и при этом внутренняя энергия системы убывает ( рис.1).
 ΔН, Эндотермический процесс
ΔН, Эндотермический процесс
кДж/ моль ∆H >0
ΔНконеч 

ΔНисх


Экзотермический процесс
∆H < 0
 ΔНконеч
ΔНконеч
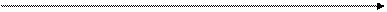
Координата реакции Х
Рис.1. Энергетические диаграммы экзотермических и эндотермических реакций
2-е следствие:Энтальпия химической реакции равна разности сумм энтальпий сгорания исходных веществ и продуктов реакции, умноженных на их стехиометрические коэффициенты.
DН0 298хр = S (niDН0 298сгор)исх - S (niDН0 298сгор)прод . (6)
Дата добавления: 2015-07-22; просмотров: 3049;
