ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
Этот закон является одной из форм закона сохранения энергии и имеет несколько формулировок, из которых наиболее распространенными являются: 1. Энергия не создается из ничего и не уничтожается, она лишь переходит из одной формы в другую; 2. В любом процессе тепло, поглощенное системой, идет на увеличение внутренней энергии и на совершение работы.
Первое начало термодинамики представляет собой постулат – оно не может быть доказано логическим путем, или выведено из каких-либо более общих положений. Истинность этого постулата подтверждается тем, что ни одно из его следствий не находится в противоречии с опытом. Первое начало термодинамики устанавливает соотношение между теплотой Q, работой А и изменением внутренней энергии системы ΔU.
Рассмотрим первое начало термодинамики на примере работы паровой машины.
 |

|
 F
F
∆X 



|


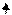 | 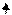 | 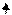 |
Q
Здесь Q– подводимоек паровому котлу тепло, которое расходуется на увеличение теплосодержания жидкости и на ее испарение.
Генерируемый в котле пар давит на поршень и перемещает его на расстояние ∆X, увеличивая при этом объем рабочей камеры паровой машины на величинуDV = ∆X × S. Здесь S– площадь поршня. Так, с помощью поршня совершается работа против внешних сил F.
Таким образом, тепло, подводимое к системе, расходуется на увеличение внутренней энергии системы и на совершение работы. В математической форме первый закон термодинамики можно записать в виде ур. 1.
Q = DU + A.(1)
Здесь А = рDV, р – давление, создаваемое паром в рабочей камере паровой машины, а DV–изменение ее объема.
Рассмотрим первое начало термодинамики в приложении к различным условиям (мы будем рассматривать простейший случай – паровую машину).
Изохорный процесс. (V = const; ΔV = 0).Объем рабочей камеры машины в этом случае не меняется – поршень застопорен.
Поскольку работа расширения равна произведению давления на изменение объема рDV , а DV = 0, то для изохорного процесса получаем:
DU = QV . (2)
Как видно, в изохорных условиях (V = const) все подведенное к системе тепло расходуется только на увеличение внутренней энергии системы: А = 0; QV = ∆U.
Изобарный процесс.(P = const). Большинство химических процессов протекает при р = const , то есть в открытых сосудах, например в колбах, пробирках, открытых реакторах и ваннах, причем чаще всего при р = 1 атм.
Тогда подводимое к системе тепло расходуется на увеличение внутренней энергии и на совершение работы расширения газа:
Qp =U2 – U1 + р(V2 -V1) или Qp =U2 – U1 + А.
Это уравнение можно переписать в форме
Qp = (U2 + рV2) - (U1 + рV1); (3)
Qp = ∆H = ∆U + рDV.
Из уравнения (3) следует, что подводимая в изобарных условиях к системе теплота расходуется на приращение некоторой функции состояния, которая называется энтальпией, или - энергией расширенной системы:
H = U + рV (кДж/моль). (4)
Таким образом, изменение энтальпии – это теплота, подведенная к системе при изобарном процессе (Qp = ∆H), которая расходуется на изменение внутренней энергии и на совершение работы.
Энтальпия, как и внутренняя энергия, зависит от природы, физического состояния и от количества вещества.
Условно считается, что энтальпии образования (про энтальпии образования веществ смотри ниже) простых газов, простых твердых и жидких веществ в одной из наиболее устойчивых аллотропных модификаций в стандартных условиях равны нулю. Например ∆Н°298 образования:
С (графит) - (0 кДж/моль); алмаз - (1,828 кДж/моль);
Sn (белое) - (0 кДж/моль); Sn (серое) - (-2,1 кДж/моль);
Р (красный) - (-17,6 кДж/моль); Р (белый) - (0 кДж/моль);
S (ромб) - (0 кДж/моль); S (моноклинич) - (0,38 кДж/моль);
Дата добавления: 2015-07-22; просмотров: 938;
