Образование слабых электролитов
а) простые вещества:
2KCN + H2SO4 ®2HCN + K2SO4 (МУ)
2K+ + 2CN- + 2H+ +SO42- ® 2HCN + 2K+ +SO42- (ИМУ)
CN- + H+ ® HCN (Кд HCN = 7,8•10-10) –ионно-молекулярное ур-е образования слабого электролита HCN.
б) комплексные соединения:
ZnCl2 + 4NH3 ® [Zn (NH3)4]Cl2 (МУ)
Zn2+ + 2Cl- +4NH3 ® [ Zn (NH3)4]2+ + 2Cl- -(ИМУ)
Zn2++4NH3 ® [Zn(NH3)4]2+- краткое ионно-молекулярное уравнение образования комплексного катиона.
Встречаются процессы, при которых слабые электролиты или малорастворимые соединения входят в число исходных веществ и продуктов реакции. Равновесие в этом случае смещается в сторону образования веществ, имеющих наименьшую константу диссоциации или в сторону образования менее растворимого вещества:
А) NH4OH + HCl ® NH4Cl + H2O (МУ)
NH4OH + H+ + Cl- ® NH4+ + Cl- + H2O
NH4OH + H+ ® NH4+ + H2O (ИМУ)
Кд(NH4OH) =1,8× 10-5 > Кд(H2O) =1,8×10-16.
Равновесие сдвинуто в сторону образования молекул воды.
Б) AgCl¯ + NaI ®AgI¯ + NaCl (МУ)
AgCl¯ + Na+ +I- ®AgI¯+ Na+ +Cl-
AgCl¯ + I- ®AgI¯ + Cl- (ИМУ)
ПРAgCl=1,78×10-10 > ПРAgI =8,3×10-17.
Равновесие сдвинуто в сторону образования осадка AgI.
В) Могут встречаться процессы, в уравнениях которых есть и малорастворимое соединение и слабый электролит
MnS¯ + 2HCl ® MnCl2 + H2S (МУ)
MnS¯ + 2H+ +2Cl- ® Mn 2+ + 2Cl- + H2S
MnS¯ + 2 H+ ® Mn2+ + H2S (ИМУ)
ПРMnS=2,5×10-10; [S-2]= 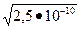 =1,58.10-5 моль/л
=1,58.10-5 моль/л
Kд H2S= K1×K2 = 6×10-22; [S2-] = 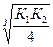 =5,4.10-8 моль/л
=5,4.10-8 моль/л
Связывание ионов S2- в молекулы H2S происходит полнее, чем в MnS, поэтому реакция протекает в прямом направлении, в сторону образования H2S
Дата добавления: 2015-07-22; просмотров: 1184;
