Диссоциация воды. рН - водородный показатель
Вода хотя и весьма незначительно, но все же диссоциирует на ионы:
Н2О ↔ Н+ + ОН-. Следовательно, вода является типичным амфотерным электролитом, т.е. она может действовать в равной степени и как кислота и как основание. Установлено, что константа диссоциации воды равна 

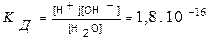 .
.
Судя по значению этой величины, вода является очень слабым электролитом. Произведение концентраций водородных и гидроксид-
ионов, которое при данной температуре является постоянной величиной,
называется ионным произведением воды, его обозначают Кw или КН2О. При 250С Кw =[Н+][ОН-]=10-14. Для процессаН+(р) + ОН- (р) ® Н2О(р) ,
DН0298 = -56кДж/моль; обратный процесс - диссоциация воды является эндотермическим процессом. Отсюда, в соответствие с принципом Ле-Шателье, температура будет оказывать влияние на Кw.
Для характеристики кислотности раствора используют водородный показатель (рН). рН = - lg[H+], где [H+] - концентрация ионов водорода в моль/л. Т.к. Кw ¹ 0, то и не может быть водного раствора, в котором концентрация Н+ или ОН- равнялась бы нулю. Следовательно, в любом водном растворе присутствуют совместно ионы Н+ и ОН-. Для нейтральной среды [Н+] = [ОН-] = 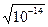 =10-7 моль/л, следовательно рН=7. В кислой среде [Н+]> 10-7 моль/л, т.е. 0< рН <7, в щелочной среде [ОН-] > 10-7моль/л, т.е. 7 < рН £ 14.
=10-7 моль/л, следовательно рН=7. В кислой среде [Н+]> 10-7 моль/л, т.е. 0< рН <7, в щелочной среде [ОН-] > 10-7моль/л, т.е. 7 < рН £ 14.
Шкала рН для ст.усл.:
[Н+], моль/л: 1 10-7 10-14
 |
рН : 0 кислая среда 7 щелочная среда 14
Дата добавления: 2015-07-22; просмотров: 1111;
