Лабораторна робота №216. ДОСЛІДЖЕННЯ ПРОЦЕСУ ПЛАВЛЕННЯ КРИСТАЛІЧНИХ РЕЧОВИН
Завдання: визначити температуру плавлення (кристалізації) за кривими нагрівання (охолодження) металу і зміну ентропії цього процесу.
Приладдя: установка для дослідження процесу плавлення металів; набір тиглів з металами; термометр, барометр, секундомір.
Теоретичний матеріал, який необхідно засвоїти під час підготовки до виконання роботи: процеси плавлення та кристалізації твердих тіл; кристалічні та аморфні тіла; фазові переходи першого роду, питома теплота фазових переходів; рівняння Клапейрона–Клаузіуса; ентропія; термопарний метод вимірювання температури.
Література:
1) § 21.3–21.5, c. 407–414;
2) § 22.4–22.6, c. 134–138;
3) §70, с. 219–222;
 4) § 75–76, с. 124–127; § 247, с. 398–400.
4) § 75–76, с. 124–127; § 247, с. 398–400.
Опис установки.
Установка для дослідження процесу плавлення металів показана на рис. 20. Вона складається з електропечі 1 для нагрівання тигля з металом 3, поворотного стола 2 з ручкою керування 4, на якому закріплені чотири тиглі з різними металами. Термопара 5 разом з потенціометром 7 утворюють електричний термометр, за допомогою якого вимірюють температуру металу в тиглі. Саму термопару можна переміщувати по вертикалі, якщо обертати гвинт повзунка 6. Секундоміром 8 вимірюють час. Перемикач 9 призначений для увімкнення живлення електропечі 1.
Ідея роботи та виведення робочої формули. Під час нагрівання кристалічної речовини кінетична енергія її атомів збільшується і, відповідно, підвищується температура тіла. У разі досягнення температури плавлення Тпл зовнішня енергія, якої набуває тіло, витрачається на руйнування кристалічної ґратки, тому температура тіла не буде підвищуватися, доки вся речовина не перейде в рідкий стан. Процес плавлення належить до фазових переходів першого роду. Його описує рівняння Клапейрона–лаузіуса
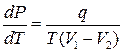 , (1)
, (1)
де P – тиск; Т – абсолютна температура; q – питома теплота фазового переходу; V2 і V1 – об’єми речовини в твердому і рідкому станах, відповідно.
Кількість теплоти, яка необхідна для того, щоб перевести одиницю маси речовини з твердого стану в рідкий за сталих температури і тиску, називають питомою теплотою плавлення (кристалізації) l. Отже, для повного розплавлення (кристалізації) кристалічної речовини масою mза температури Тпл потрібно затратити кількість теплоти
Q = ±lm. (2)
Знак плюс відповідає поглинанню теплоти під час плавлення тіла, а мінус – виділенню теплоти під час кристалізації.
 Ентропія S є мірою розупорядкованості термодинамічної системи. З огляду на це під час плавлення речовини її ентропія повинна збільшуватись, оскільки для кристалічного стану харак-терний як ближній, так і дальній порядок, а для рідкого – тільки ближній. Зміну ентропії під час плавлення кристалічної речовини можна обчислити за формулою Клаузіуса
Ентропія S є мірою розупорядкованості термодинамічної системи. З огляду на це під час плавлення речовини її ентропія повинна збільшуватись, оскільки для кристалічного стану харак-терний як ближній, так і дальній порядок, а для рідкого – тільки ближній. Зміну ентропії під час плавлення кристалічної речовини можна обчислити за формулою Клаузіуса
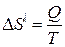 або
або 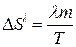 . (3)
. (3)
Розглянемо тепер детальніше процес плавлення кристалічної речовини. На діаграмі плавлення (рис. 21) показана зміна температури речовини з часом унаслідок її нагрівання. Ділянка ОА відповідає нагріванню твердої, а ВС – рідкої фази речовини. Процесу плавлення відповідає ділянка АВ. Як бачимо, під час плавлення кристалічної речовини протягом часу Dtїї температура не змінюється. Ця температура і є температурою плавлення Тплдосліджуваної речовини. Отже, за діаграмою плавлення можна визначити температуру плавлення речовини і, знаючи її масу та питому теплоту плавлення, обчислити за формулою (3) зміну ентропії в цьому процесі.
У цій роботі для визначення зміни ентропії використовують порівняльний метод, оскільки питома теплота плавлення відома лише для одного з досліджуваних металів (олова). Експериментальна установка забезпечує однакову тепловіддачу в системі тигель з металом–електропіч. Тому кількість теплоти, яку отримує (чи втрачає) метал, пропорційна до часу t. Отже, визначивши час повної кристалізації Dt для двох із досліджуваних металів, можна записати
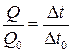 , (4)
, (4)
де Q і Q0– теплоти плавлення досліджуваного металу й олова; Dt i Dt0–їхні часи кристалізації. Звідси
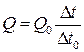 ,
,
або, врахувавши (2),
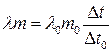 , (5)
, (5)
де m та m0 – маси досліджуваного металу й олова; l, l0 – їхні питомі теплоти плавлення.
Якщо маси металів у тиглях однакові, то
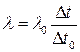 . (6)
. (6)
Підставивши (6) у (3), отримаємо
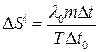 . (7)
. (7)
Поділимо обидві частини рівняння (7) на m і, врахувавши, що DS=DS|/m – зміна ентропії одиниці маси речовини, матимемо
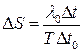 . (8)
. (8)
Формула (8) є робочою формулою цієї лабораторної роботи.
Дата добавления: 2015-07-22; просмотров: 1041;
