Лабораторна робота № 215. ДОСЛІДЖЕННЯ КРИТИЧНОГО СТАНУ РЕЧОВИНИ
Завдання: визначити критичну температуру ефіру.
Приладдя: установка для дослідження критичного стану речовини ампула з ефіром.
Теоретичний матеріал, який необхідно засвоїти під час підготовки до виконання роботи: ідеальний і реальний гази; рівняння Ван-дер-Ваальса; ізотерми ідеального та реального газів, метастабільні стани; критичний стан речовини, критичні параметри та їхнє виведення з рівняння стану; зрідження газів; фазові переходи.
Література:
1) § 17.1–17.3, с. 326–336; § 17.5, c. 341–344;
2) § 17.2–17.5, c. 56–62;
3) § 64–66, с. 203–210.
4) § 60–65, с. 103–111.
 Опис установки. Установка для дослідження критичного стану речовини (рис. 17) складається з електричного нагрівника 1, призначеного для нагрі-вання ампули з ефіром 4, який живиться напругою 220 В через вимикач 6. Ам-пула
Опис установки. Установка для дослідження критичного стану речовини (рис. 17) складається з електричного нагрівника 1, призначеного для нагрі-вання ампули з ефіром 4, який живиться напругою 220 В через вимикач 6. Ам-пула  розміщена безпосередньо над нагрівником і перебуває в контакті зі спаєм термопари 3. Термопара 3 разом із потенціометром 5 утворюють елек-тричний термометр, який вимірює температуру ампули 4. Під час повільного нагрівання температура ампули з достатньою точністю відповідає температурі ефіру. Ампула з ефіром, нагрівник і термопара розміщені в захисному корпусі 2.
розміщена безпосередньо над нагрівником і перебуває в контакті зі спаєм термопари 3. Термопара 3 разом із потенціометром 5 утворюють елек-тричний термометр, який вимірює температуру ампули 4. Під час повільного нагрівання температура ампули з достатньою точністю відповідає температурі ефіру. Ампула з ефіром, нагрівник і термопара розміщені в захисному корпусі 2.
Ідея роботи та виведення робочої формули. Теоретичною основою дослідження критичного стану речовини є рівняння стану реального газу – рівняння Ван-дер-Ваальса. Для одного моля (кіломоля) реального газу це рівняння записують так:
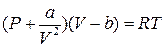 , (1)
, (1)
де P, V i Т – відповідно, тиск, об’єм і температура одного моля газу; а і b – поправки Ван-дер-Ваальса на внутрішній тиск і власний об’єм усіх молекул газу; R – універсальна газова стала.
Для різних газів поправки а і b різні за значенням. На рис. 18 показані ізотерми реального газу для різних значень температур. Суцільні криві відповідають експериментальним, а криві з штрих-пунктирними ділянками ВВ1СС1 – теоретичним ізотермам. З графіків видно, що з підвищенням температури горизонтальна ділянка ізотерми ВС, яка відповідає двофазовому стану речовини (рідина + насичена пара), зменшується, стягуючись за критичної температури ТK в точку, і дві фази речовини стають нерозрізнюваними. Цій точці відповідають параметри ТK, PK, VK, які визначають критичний стан речовини. Критичні параметри речовини ТK, PK, VK можна визначити, розв’язавши рівняння (1):
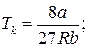
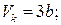
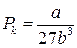 . (2)
. (2)
Критична температура – це температура, за якої зникає різниця між рідиною та її насиченою парою. При ТKпитома теплота пароутворення і коефіцієнт поверхневого натягу рідини a дорівнюють нулю. При Т>ТK речовина може існувати лише в стані газу, який неможливо перевести в рідину шляхом ізотермічного стиску. При Т<ТK речовина може існувати у стані як рідини, так і насиченої пари.
 Критичний тиск – це максимально можливий тиск насиченої пари заданої речовини, а критичний об’єм – максимальне значення об’єму, який може займати речовина в рідкому стані.
Критичний тиск – це максимально можливий тиск насиченої пари заданої речовини, а критичний об’єм – максимальне значення об’єму, який може займати речовина в рідкому стані.
У нашому випадку досліджувана речовина перебуває в замкнутому об’ємі (ефір у запаяній скляній ампулі). Над поверхнею ефіру є насичена пара. З підвищенням температури інтенсивність випаровування ефіру збіль-шується, отже, густина пари rн також збільшується, а густина рідини rр – зменшується (рис. 19). Коли температура досягає критичної, то rн=rр. Поряд з цим, як зазначено вище, за такої температури a=0, тоді межа поділу між рідиною та її насиченою парою зникне.
Отже, експериментально ТK можна визначити шляхом візуального спостереження за зникненням (появою) меніска в запаяній скляній ампулі під час її нагрівання (охолодження). Цей метод, уперше запропонований київським фізиком М. Авенаріусом, застосований у нашій роботі.
Якщо в експерименті виміряти t1°C (температуру, при якій зникає меніск в ампулі) і t2°C– (температуру, за якої меніск з’являється, якщо ампулу охолоджувати), то ТK можна визначити так:
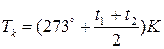 . (3)
. (3)
Вираз (3) є робочою формулою лабораторної роботи.
Дата добавления: 2015-07-22; просмотров: 1532;
