Енергія міжмолекулярної взаємодії. Потенціал Ленарда–Джонса
Точну характеристику залежності Еп(r) можна дати лише для конкретних молекул. У загальному
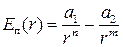 . (1.5)
. (1.5)
Дослідження доводять, що для молекул рідин і газів достатньо добре наближення отримують за умови n=12, m=6. Тоді, записавши (1.5) через потенціал парної взаємодії φ(r),отримаємо
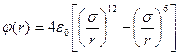 , (1.6)
, (1.6)
де перший доданок відповідає відштовхуванню, а другий – притяганню молекул, σ – найменша відстань зближення молекул, коли φ(σ)=0.
Вираз (1.6) називають потенціалом Леонарда–Джонса. Зазначимо, що формула (1.6) враховує взаємодію лише двох молекул, що можливо тільки для газів. У рідинах треба враховувати вплив сусідніх молекул, що суттєво ускладнює задачу. Водночас потенціал Ленарда–Джонса повністю придатний для наближеної оцінки сил і потенціалу взаємодії.
Спробуємо скористатись виразом (1.6), щоб оцінити залежність ван-дер-ваальсівських сил від відстані між молекулами.
На підставі рис. 1.3 запишемо напруженість електричного поля, створеного першим диполем на відстані r:
 . (1.7)
. (1.7)
Оскільки 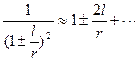 і
і 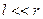 , то
, то
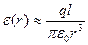 . (1.8)
. (1.8)
Обчислимо тепер силу, з якою це поле діє на другу поляризовану молекулу:
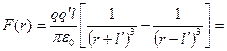
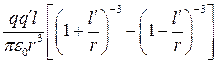 . (1.9)
. (1.9)
Оскільки 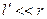 і
і 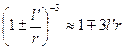 , то
, то
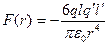 . (1.10)
. (1.10)
З урахуванням того, що поляризованість молекули прямо пропорційна до напруженості поля ε, тобто 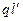 ~ ε ~
~ ε ~ 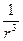 , отримаємо
, отримаємо
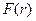 ~
~ 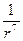 . (1.11)
. (1.11)
Отже ван-дер-ваальсівська сила притягування двох молекул дуже швидко зменшується зі збільшенням відстані між ними.
Дата добавления: 2015-07-22; просмотров: 1112;
