Болезни гипоталамуса и гипофиза
Болезни, поражающие гипоталамус и гипофиз, могут проявляться симптомами как со стороны эндокринной системы, так и других систем организма.
Гипоталамус. Масса гипоталамуса человека составляет примерно 4 г. Нарушения его функции проявляются только при двустороннем поражении. Опухоли этой локализации растут, как правило, медленно. Они могут достигать больших размеров, прежде чем проявятся симптомы болезни. Наряду с признаками гипопитуитаризма и дисфункции гипоталамуса развиваются симптомы гидроцефалии или очаговых мозговых нарушений, что подчас делает клиническую картину очень запутанной.
Гипоталамус влияет на функции как эндокринной, так и неэндокринной систем организма. Гипоталамическая регуляция гипофиза обсуждалась ранее. К неэндокрннным функциям, находящимся под влиянием гипоталамуса, относятся следующие.
1. Потребление калорий и пищевое поведение. Базальная область гипоталамуса необходима для поддержания стабильной массы тела. Вентромедиальное ядро участвует в создании чувства насыщения, латеральный гипоталамус — чувства голода. Повреждение вентромедиального ядра обычно сопровождается гипоталамическим ожирением. Это ожирение связано, по-видимому, с перенастройкой установочной точки для массы тела. Пока масса не достигнет новой установочной точки, отмечается выраженная гиперфагия, обусловленная, возможно, быстрым опустошением желудка. После достижения этой точки больные часто начинают есть реже и меньше. Повреждения латерального гипоталамуса могут сопровождаться афагией. К другим факторам, влияющим на пищевое поведение, относятся гипотиреоз и недостаточность надпочечников, при которых снижается аппетит.
2. Регуляция температуры. В переднем гипоталамусе находятся чувствительные к теплу и холоду нейроны, которые реагируют на изменения локальной и окружающей температуры. Задний гипоталамус генерирует сигналы, необходимые для теплоотдачи. Повышение температуры тела при инфекционных заболеваниях определяется гипоталамусом. Фагоцитирующие клетки, присутствующие во всех частях туловища, продуцируют интерлейкин-1 (эндогенный пироген), который стимулирует продукцию простагландина Е2 передним гипоталамусом. Простагландин Е2 сдвигает установочную точку для температуры тела вверх, что обусловливает сохранение тепла (например, вазоконстрикцию) и увеличение теплопродукции (например, дрожание мышц) до тех пор, пока температура крови и ядра не будет соответствовать новому положению установочной точки в гипоталамусе.
При заболеваниях гипоталамуса регуляция температуры может нарушаться. Редким следствием диффузного поражения гипоталамуса является гипотермия. Может иметь место пароксизмальная гипотермия с потоотделением, гиперемией и снижением температуры тела; при острых патологических процессах, таких как кровоизлияние в III желудочек, наблюдалась стойкая гипертермия без тахикардии. Поражения заднего гипоталамуса обычно обусловливают пойкилотермию (изменение температуры тела больше чем на 1 "С при изменении температуры окружающей среды). Изредка возникает пароксизмальная гипертермия с приступами потрясающего озноба, резким повышением температуры и нарушением вегетативных функций. Важно помнить, что лихорадка или гипотермия могут быть следствием недостаточности надпочечников и что гипотермия может быть связана и с гипотиреозом.
3. Цикл сон — бодрствование. В переднем гипоталамусе расположен центр сна; повреждение этой области приводит к бессоннице. Задний гипоталамус обеспечивает пробуждение и сохранение состояния бодрствования; разрушение заднего гипоталамуса вследствие ишемии, энцефалита или травмы может сопровождаться повышенной сонливостью с сохранением возможности пробуждения. Более обширные повреждения, захватывающие ретикулярную формацию ростральной части среднего мозга, вызывают кому (см. гл.21).
4. Память и поведение. Повреждения вентромедиального гипоталамуса и премаммилярной области приводят к потере кратковременной памяти, часто в сочетании с корсаковским синдромом. Долговременная память обычно не страдает. Повреждения гипоталамуса могут сопровождаться также типичной картиной деменции. При вентромедиальных повреждениях возникают приступы ярости, тогда как при разрушении латерального гипоталамуса — состояние апатии.
5. Жажда. Гипоталамус является центром продукции АВП и регуляции жажды посредством изменения осмоляльности плазмы. При повреждении гипоталамуса могут иметь место нарушения чувства жажды; изредка возникает первичная полидипсия без несахарного диабета.
6. Функция автономной нервной системы. Передний гипоталамус стимулирует парасимпатические пути, задний — симпатические. В редких случаях возникает диэнцефальная эпилепсия, проявляющаяся приступами гиперактивности автономной нервной системы.
Диэнцефальный (гипоталамический) синдром у детей, характеризующийся истощением, гиперкинезом и неадекватными психическими реакциями, часто с оптимистической окраской, обычно является следствием инвазивных опухолей переднего и базального гипоталамуса. Большинство таких детей погибают до 2-летнего возраста, но у выживших клиническая картина меняется, и в ней преобладают повышение аппетита с ожирением, раздражительность или приступы ярости.
Как правило, медленно растущие опухоли чаще обусловливают деменцию, нарушения потребления пищи (ожирение или истощение) и дисфункцию эндокринной системы. Острые деструктивные процессы чаще сопровождаются комой или нарушениями автономной нервной системы.
К болезням переднего гипоталамуса относят краниофарингиомы, глиомы зрительных нервов, менингиомы гребня основной кости, гранулематозные заболевания (в том числе саркоидоз), герминомы и аневризмы внутренних сонных артерий. В гипоталамус могут прорастать также супраселлярные аденомы гипофиза и менингиомы бугорка турецкого седла. Повреждения заднего гипоталамуса обусловливаются глиомами, гамартомами, эпендимомами, герминомами и тератомами.
Преждевременное половое созревание, особенно у мальчиков, часто связано с «пинеаломами», что породило представление о значении эпифиза.в регуляции секреции гонадотропинов. Однако эти «пинеаломы» на самом деле являются герминомами, и преждевременное половое созревание обусловливается, по-видимому, эктопической секрецией ХГЧ этими опухолями, а не влиянием на гипофизарные гонадотропины.
Краниофарингиомы. Краниофарингиомы развиваются из остатков кармана Ратке. Большинство таких опухолей располагается супраселлярно, но примерно 15%— в пределах турецкого седла. Они целиком или частично состоят из кист, нередко содержат кальций и выстланы слоистым чешуйчатым эпителием. Хотя считается, что краниофарингиомы — это болезнь детского возраста, 45% больных к моменту установления диагноза оказываются старше 20 лет, а 20% — старше 40 лет.
Примерно у 80%) детей симптомы повышения внутричерепного давления с головными болями, рвотой и отеком сосков зрительных нервов обусловлены гидроцефалией. Потеря зрения и сужение полей зрения встречаются в 60% случаев. Иногда дети отличаются низкорослостью (7—40%), но чаще у них наблюдают отставание к;остного возраста. Примерно в 20% случаев отмечают запаздывание полового развития, а в ряде случаев — несахарный диабет.
Примерно 80% взрослых больных жалуются на ухудшение зрения, и еще у 10% зрительные нарушения выявляют при тщательном обследовании. Отек зрительного нерва обнаруживают примерно у 15% взрослых больных. Около 40% страдают головными болями, 25%—расстройствами психики или изменениями личности, 25%—гипогонадизмом. Гиперпролактинемия отмечается у 30—50% больных, но уровень пролактина редко превышает 100—150 нг/мг::. Могут иметь место также несахарный диабет (15%), увеличение массы тела (15%) и пангипопитуитаризм (7%). В редких случаях содержимое кисты изливается в спинномозговую жидкость, давая картину асептического менингита.
У большинства больных и некоторых взрослых с краниофарингиомой при рентгеноскопии черепа обнаруживают супраселлярную кальцификацию (см. рис. 321-14) в виде хлопьев, гранул или криволинейных отложений. Однако при КТ-сканировании кальцификацию выявляют и у большинства взрослых больных. Гипоталамические герминомы также могут подвергаться кальцификации. К рентгенологическим признакам, помимо кальцификации, относятся увеличение турецкого седла и последствия повышения внутричерепного давления, которые имеются у 90% детей и 60% взрослых больных.
Относительно лечения больных с краниофарингиомами мнения расходятся. Многие рекомендуют полное удаление опухоли, тогда как другие предлагают биопсию и частичную их резекцию с последующим обычным облучением. У больных с опухолями диаметром менее 3 мм прогноз более благоприятный.
Опухоли из зародышевых клеток. Герминомы возникают кзади или кпереди от III желудочка (супра- и интраселлярно) в обоих местах (см. также гл. 297). Герминомы (называемые также атипичными тератомами) ранее путали с паренхиматозными опухолями эпифиза (пинеаломами): при их расположении кпереди от III желудочка они назывались «эктопическими пинеаломами». Герминомы часто инфильтрируют гипоталамус и иногда метастазируют в СМЖ или отдаленные области.
Большинство больных страдают несахарным диабетом в сочетании с недостаточностью передней доли гипофиза той или иной степени. У мальчиков может наблюдаться преждевременное половое развитие, вероятно, вследствие продукции этими опухолями ХГЧ. Часто встречаются диплопия, головная боль, рвота, летаргия, похудание и гидроцефалия. Опухоли обычно начинают расти в детском возрасте, но могут диагностироваться впервые после достижения больным половой зрелости. Так как герминомы обладают высокой радиочувствительностью, раннее их выявление приобретает особую важность. При расположенин опухоли кпереди от III желудочка часто удается произвести биопсию транссфеноидальным путем. Получить биоптат опухолей, располагающихся в области эпифиза, труднее, что побуждает некоторых авторов рекомендовать эмпирическую лучевую терапию или химиотерапию, тогда как другие предпочитают хирургическую биопсию и резекцию с последующим облучением или химиотерапией. Герминомы иесеминомного типа могут продуцировать ХГЧ и/или -фетопротеин, тогда как чистые семиномы редко продуцируют опухолевые маркеры (см. гл. 297).
Аденомы гипофиза. На долю аденом гипофиза приходится примерно 10—15% всех внутричерепных новообразований. Они могут нарушать соотношение гормонов передней доли гипофиза, прорастать в окружающие ткани или вызывать синдромы избытка гормонов. Иногда они диагностируются случайно при рентгенологическом исследовании черепа.
Патологические изменения. На протяжении многих лет классификация опухолей гипофиза основывалась на результатах их окрашивания гематоксилином и эозином. Различают базофильные, ацидофильные и хромофобные опухоли. Кортикотропные аденомы, как правило, базофильны; плотно гранулированные опухоли, секретирующие пролактин, ацидофильны; большинство пролактином, малогранулированные ГР-секретирующие, ТТГ-секретирующие и гонадотропинсекретирующие опухоли, а также несекретирующие опухоли относят к хромофобным. Поскольку эта классификация мало что говорит о характере продуцируемых гормонов, от неё отказались. Однако еще до сих пор за многими нефункционирующими опухолями гипофиза сохраняется название «хромофобные». Классификация. основанная на иммуногистохимическом окрашивании, позволяет идентифицировать и локализовать отдельные гормоны. Кроме того, опухоли гипофиза можно классифицировать в соответствии с характером секретируемых гормонов по результатам определения последних в сыворотке крови.
С другой стороны, классификация опухолей гипофиза может основываться на их размерах и инвазивных свойствах. Опухоли I стадии — это микроаденомы (менее 10 мм в диаметре): появление их может сопровождаться гиперсекрецией гормонов, но не вызывать гипопитуитаризма и не создавать структурных проблем. Опухоли II стадии это макроаденомы (более 10 мм) с супраселлярным распространением или без него. Опухоли III стадии — тоже макроаденомы, локально инвазирующие дно турецкого седла и способные вызывать его увеличение, распространяясь супраселлярно. Опухоли IV стадии — инвазивные макроаденомы, вызывающие диффузное разрушение турецкого седла независимо от супрасселярного распространения. Недостаток этой системы классификации заключается в том, что не все гипофизарные опухоли точно соответствуют одной из стадий. Трудно, например, разграничить истончение дна турецкого седла (стадия II) и его эрозию (стадия III).
Эндокринные проявления. Избыточную продукцию гормонов передней доли гипофиза предполагают, исходя из клинических признаков, а затем уже подтверждают лабораторными исследованиями (табл. 321-5). Наиболее часто встречающимися секреторными опухолями гипофиза являются пролактиномы. Они вызывают галакторею и гипогонадизм, включая аменорею, бесплодие и импотенцию. Следующее по частоте распространенности место занимают ГР-секретирующие опухоли, вызывающие акромегалию и гигантизм. Далее следуют кортикотропные аденомы (АКТГ-секретнрующие), обусловливающие избыток кортизола (болезнь Кушинга). Реже всего встречаются аденомы гипофиза, секретирующие гликопротеидные гормоны (ТТГ, ЛГ или ФСГ). ТТГ-секретирующие аденомы лишь в редких случаях служат причиной гипертиреоза. Парадоксально, что у большинства больных с гонадотропинсекретирующими опухолями отмечают гипогонадизм.
Примерно у 15%i больных с опухолями, направляемых на операцию, аденомы секретируют не один. а несколько гипофизарных гормонов. Чаще всего встречается комбинация ГР и пролактина, нередко комбинируется также гиперсекреция ГР и ТТГ, ГР. пролактина и ТТГ, АКТГ и пролактина. В большинстве таких опухолей содержатся клетки одного типа. секретирующие сразу два гормона (одиоморфные опухоли), но в некоторых опухолях присутствуют клетки двух или нескольких типов, при этом клетки каждого типа продуцируют по одному гормону (полиморфные опухоли).
Пролактиномы у женщин и кортикотропные аденомы у женщин и мужчин обычно диагностируют еще на стадии микроаденом. Напротив, у большинства больных акромегалией и у большинства мужчин с пролактиномами к моменту постановки диагноза имеются уже макроаденомы. Опухоли, секретирующие гликопротеидные гормоны, к моменту установления диагноза обычно тоже достаточно велики.
Примерно у 25% больных, перенесших операцию, аденомы оказываются функционально неактивными, хотя часть из них дает иммунологическую реакцию на гипофизарные гормоны. В некоторых случаях, особенно при гонадотропинсекретирующих опухолях, гормональная активность остается нераспознанной. Часть «нефункционирующих» опухолей гипофиза, равно как и некоторые функционирующие, секретируют неполные молекулы гликопротеидных гормонов, чаще всего альфа-субъединицу. Избыток альфа-субъединиц нередко обнаруживают у больных с ТТГ-сскретирующими аденомами, а у больных с гонадотропинсекретирующими опухолями может иметь место гиперсекреция бета-субъединицы ФСГ.
Нуль-клеточные опухоли (в которых при иммуноокрашивании специфические гормоны не выявляются), как правило, к моменту установления диагноза имеют большие размеры, поскольку отсутствие гиперсекреции гормонов исключает ранние диагностические признаки. У пожилых люден часто обнаруживают онкоцитомы — несекретирующие аденомы гипофиза с большим количеством митохондрий.
Аденомы гипофиза иногда являются частью синдрома множественных эндокринных неоплазий (МЭН I) (см. гл. 334). Это доминантно наследуемое заболевание служит причиной аденом гипофиза, секреторных опухолей эндокринной части поджелудочной железы и гиперпаратиреоза, обусловленного генерализованной гиперплазией околощитовидных желез. При этом чаще встречаются аденомы гинофиза, секретирующие ГР и пролактин, по нередки и нефункционирующне опухоли. Наиболее часто при синдроме МЭН I обнаруживаются инсулиномы и гастрнномы. Панкреатические ГРГ-секретирующие опухоли, вызывающие акромегалию и гиперплазию клеток гипофиза, могут иметь поверхностное сходство с синдромом МЭН I.
Эффекты, связанные с массой опухолей гипофиза. Нарушение полей зрения. Перекрест зрительных нервов располагается спереди и сверху гипофиза и у 80% здоровых людей накрываст гипофизарную ямку; примерно у 10% перекрест на
Таблица 321-5. Методы оценки секреции гормонов гипофиза
| Гормон | Избыток | Недостаточность |
| Гормон роста | 1. Определение уровня гормона роста в плазме крови через 1 ч после перорального приема глюкозы 2. Определение уровня ИФР-1/СМ-С | 1. Определение уровня гормона роста в плазме крови через 30, 60 и 120 мин после одной из следующих процедур: а) внутривенное введение обычного инсулина в дозе 0,1—0,15 ЕД/кг б) пероральный прием леводопы в дозе 10 мг/кг в) внутривенное введение L-аргинина в дозе 0,5 мг/кг за 30 мин 2. ? Определение ИФР-1/СМ-С |
| Пролактин | 1. Определение базального уровня пролактина в сыворотке крови | 1. Определение уровня пролактина в сыворотке крови через 10—20 мин после одной из следующих процедур: а) внутривенное введение ТРГ в дозе 200—500 мкг б) внутримышечное введение хлорпромазина в дозе 25 мг |
| ТТГ | 1. Определение уровня Т4, индекса свободного Т4, Т3,ТТГ | 1. Определение уровня Т4, индекса свободного Т4, ТТГ |
| Гонадотропины | Определение ФСГ, ЛГ, тестостерона, бета-субъединицы ФСГ, реакции ФСГ на ТРГ | 1. Определение базальных уровней ЛГ и ФСГ у женщин в постклимактерическом периоде; не требуется определять у женщин при наличии менструаций и овуляций 2. Определение тестостерона, ФСГ и ЛГ у мужчин |
| АКТГ | 1. Определение уровня свободного кортизола в моче 2. Супрессивный тест с дексаметазоном по одной из следующих методик: а) определение уровня кортизола в плазме крови в 8 ч утра после введения 1 мг дексаметазона в полночь б) определение уровня кортизола в плазме крови в 8 ч утра или 17-гидроксистероидов в суточной моче после перорального приема дексаметазона в дозе U,5 мг каждые 6 ч 8 раз | 1. Определение кортизола в сыворотке крови через 30 и 60 мин после внутривенного введения обычного инсулина в дозе 0,1— 0,15 ЕД/кг 2. Определение реакции на метопирон по одной из следующих методик: а) определение 11-дезоксикортизола в плазме в 8 ч утра после приема 30 мг метопирона в полночь (максимальная доза 2 г) б) определение 17-гидроксикортикоидов в суточной моче в день приема 750 мг метопирона (каждые 4 ч 6 раз) и на следующие сутки в) определение 17-гидроксикортикоидов в суточной моче в день приема 500 мг метопирона (каждые 2 ч 12 раз) и на следующие сутки |
| Гормон | Избыток | Недостаточность |
| 3. Супрессивный тест с большой дозой дексаметазона по одной из следующих методик: а) определение уровня кортизола в плазме крови в 8 ч утра после перорального приема 8 мг дексаметазона в полночь б) определение кортизола в плазме крови или 17-гидроксистероидов в суточной моче после приема 2 мг дексаметазона каждые б ч 8 раз 4. Реакция на метопирон (по той же схеме, что и при тестировании недостаточности) 5. Реакция АКТГ плазмы на кортикотропин-рилизинг гормон (стандартной схемы нет) | 3. Стимуляционный тест с АКТГ: определение уровня кортизола в плазме до внутримышечного или внутривенного введения 0,25 мг косинтропина и через 60 мин после этого | |
| Аргинин-вазопрессин (АВП) | . Определение содержания натрия в сыворотке крови и ее осмоляльности, а также осмоляльности мочи при исключении нарушений функций почек,надпочечников и щитовидной железы 2. Одновременное определение осмоляльности сыворотки крови и уровня АВП | 1. Сравнение осмоляльности мочи и сыворотки крови в условиях повышенной секреции АВП2 2. Одновременное определение осмоляльности сыворотки крови и уровня АВП |
' С помощью тестов 1 и 2 устанавливают диагноз синдрома Кушинга. С помощью тестов 3, 4 и 5 устанавливают гипофизарное происхождение болезни Кушинга. Иногда может потребоваться двусторонняя катетеризация нижних каменистых синусов.
2 Путем лишения воды или введения солевого раствора.
ходится спереди бугорка турецкого седла (переднее положение) и у оставшихся 10% перекрывает спинку турецкого седла сзади (заднее положение). Расстояние между перекрестом сверху и диафрагмой турецкого седла снизу варьирует и иногда может достигать 1 см.
Что касается дефектов полей зрения, то чаще всего у больных с аденомами гипофиза появляется битемпоральная гемианопсия, а у 8% подобных больных наблюдаются полная потеря зрения в одном глазу и темпоральный дефект в другом. Иногда вместо гемианопсии развиваются битемпоральные скотомы. Это особенно часто наблюдается при быстро растущих опухолях у больных с передним положением перекреста зрительных нервов (см. гл. 13). Поэтому тщательное исследование полей зрения должно включать не только латеральные поля. Среди больных с дефектами нолей зрения примерно у 9% поражен один глаз; и чаще всего это верхнетемпоральный дефект. Иногда на одном глазу зрение нарушается но типу центральной скотомы, что имитирует внегипофизарную патологию. Когда аденомы гипофиза сопровождаются нарушением полей зрения, почти всегда увеличено турецкое седло.
Параличи глазодвигательных нервов. Аденомы гипофиза могут распространяться в латеральных направлениях, прорастать кавернозные синусы и вызывать паралич глазодвигательных нервов. В таких случаях нарушений полей зрения обычно не бывает. Вовлечение в процесс III черепного нерва встречается чаще всего и может имитировать диабетическую нейропатию этого нерва, при которой реактивность зрачка, как правило, сохранена. Кроме того. при латеральном распространении аденом в процесс могут вовлекаться IV и V черепные нервы; появляются боли и онемение областей, иннервируемых V нервом; отмечаются симптомы сдавления или полного пережатия сонной артерии.
Так же, как и большинство больных акромегалией, больные с крупными опухолями часто жалуются на головные боли, которые носят тупой и постоянный характер и могут усиливаться при кашле. Полагают, что они обусловлены растяжением диафрагмы турецкого седла и иррадиируют в различные области, включая темя, а также ретробульбарную, лобно-затылочную, лобно-теменную или затылочно-шейную области.
Очень крупные опухоли гипофиза могут инвазировать гипоталамус и вызывать гиперфагию, нарушение терморегуляции, потерю сознания и прекращение поступления гормональных сигналов в гипоталамус. При гипофизарных аденомах обструктивная гидроцефалия, связанная с патологией III желудочка, встречается реже, чем при краниофарингеомах. Прорастание опухоли в височную долю может вызывать сложные частичные судорожные припадки; прорастание в заднюю ямку—сопровождаться нарушением стволовых функций, а прорастание в лобные доли — вызывать изменения психического состояния и признаки потери лобных функций.
Апоплексия гипофиза. Острый геморрагический инфаркт гипофизарной аденомы служит причиной быстрого развития синдрома, включающего острую головную боль, тошноту, рвоту и помрачение сознания. Отмечаются также офтальмоплегия, нарушения зрения и реакций зрачка и менингеальные явления. Большинство этих симптомов обусловлено прямым давлением кровоизлияния в опухоль, а менингеальные явления связаны с попаданием крови в СМЖ. Синдром либо развивается за 24—48 ч, либо приводит к внезапной смерти.
Апоплексия гипофиза чаще всего возникает у больных с известными соматотропными или кортикотропными аденомами, но может быть и первым клиническим проявлением опухоли гипофиза. К геморрагическому инфаркту предрасполагают антикоагуляционная и лучевая терапия. В редких случаях апоплексия гипофиза вызывает «аутогипофизэктомию» с исчезновением клинических симптомов акромегалии, болезни Кушинга или гиперпролактинемии (своего рода «излечение»). Частым следствием является гипопитуитаризм; хотя в острой фазе синдрома при однократном определении уровня гормонов результаты могут быть нормальными, концентрация кортизола и половых стероидов снижается в ближайшие дни, а за несколько недель снижается и уровень тироксина. В редких случаях развивается несахарный диабет.
Апоплексию гипофиза следует отличать от разрыва аневризмы; нередко в такой ситуации требуется ангиография. Больные с острой апоплексией гипофиза требуют наблюдения нейрохирурга. Иногда может возникнуть необходимость в неотложной декомпрессии гипофиза, которую производят, как правило, транссфеноидальным путем.
Лечеиие больных с аденомами гипофиза. Лечение больных с аденомами гипофиза должно быть направлено на необратимую ликвидацию гиперсекреции гормонов, не вызвав при этом гипопитуитаризма, и привести к уменьшению или полному исчезновению опухолевой массы, не создав дополнительной патологии и не увеличив смертность. Лечение по поводу микроаденом может соответствовать всем этим требованиям, тогда как в случае макроаденом лечение бывает менее удовлетворительным. При рассмотрении плана лечения крайне важно сопоставить опасность, связанную с собственно опухолью, с опасностью осложнений, к которым может привести лечение. Независимо от размеров опухоли лечение не должно приносить больше вреда, чем само заболевание. Потенциально смертельные болезни, такие как болезнь Кушинга или акромегалия, могут требовать более агрессивных методов лечения, чем, например, пролактиномы.
Медикаментозная терапия. В настоящее время препаратом выбора при лечении больных с микропролактипомами (если лечение вообще требуется) является агонист дофамина бромкриптин. Это соединение снижает гиперпролактинемию практически у всех больных с микропролактиномами. Однако прекращение его приема сопровождается обычно восстановлением исходного уровня пролактина. Неясно, влияет ли лечение бромкриптином на успех последующей хирургической операции.
Побочные эффекты бромкриптина — тошноту, раздражение желудка и постуральную гипотензию — можно свести к минимуму, если прием начать с низких доз препарата (1,25 мг) вместе с пищей; при этом больной должен находиться в постели. Другие побочные эффекты включают головную боль, утомляемость, спазмы в животе, отек слизистой оболочки носа и запор. Дозы бромкриптина постепенно увеличивают до всего 2,5 мг дважды в день.
Бромкриптин эффективен также при более крупных пролактинсекретирующих макроаденомах. В таких случаях он снижает уровень пролактина почти у 90% больных, но не до нормального уровня. Примерно у 50% больных размеры опухоли сокращаются наполовину и более, а дефекты зрения могут исчезать полностью. Уменьшение размеров опухоли иногда сопровождается исчезновением симптомов гипопитуитаризма. В редких случаях уменьшение размеров гигантских аденом под действием бромкриптина вызывает внутричерепное кровоизлияние с разрушительными последствиями. К сожалению, после отмены бромкриптина рост макроаденом обычно возобновляется. При планировании беременности или в тех случаях, когда бромкриптин не устраняет эффектов, связанных с массой опухоли, часто возникает необходимость в других методах лечения (хирургическая операция или облучение).
Бромкриптин можно использовать в качестве полезного дополнительного средства для лечения больных с акромегалией, особенно при наличии сопутствующей гиперпролактинемии. Концентрация ГР редко возвращается к норме, но симптомы болезни становятся менее выраженными, а размер опухоли уменьшается. О применении бромкриптина при акромегалии следует подумать, когда уровень ГР у больного, перенесшего хирургическую операцию, остается повышенным, а также в том случае, если больной ожидает результатов лучевой терапии. Бромкриптин неэффективен по отношению к нефункционирующим хромофобным аденомам: размер опухоли не уменьшается даже при использовании высоких доз препарата.
При лечении больных с крупными пролактиномами, нечувствительными к действию агонистов дофамина, можно применять тамоксифен. Имеются сообщения о ремиссии кортикотропных аденом у отдельных больных, получавших антагонист серотонина ципрогептадин.
Хирургическое лечение. Транссфеноидальное хирургическое удаление микроаденом гипофиза — безопасный метод лечения, нормализующий секрецию гормонов. Это наблюдается уже в течение первых суток у 75% пациентов с болезнью Кушинга, обусловленной гипофизарной микроаденомой, акромегалией при концентрации ГР менее 40 нг/мл и микропролактиномами при концентрации пролактина в сыворотке менее 200 нг/мл. По данным разных клиник, начальная эффeктивнocть такой операции колеблется от 50 до 95%. К сожалению, после первоначального снижения уровня пролактина в последующие 3—5 лет гиперпролактинемия восстанавливается примерно у 17%), а через 5—10 лет — почти у 50% больных. Частота рецидивов после операции по поводу акромегалии и болезни Кушинга определена менее четко.
Смертность при транссфеноидальных операциях по поводу микроаденом гипофиза составляет 0,27%, а осложнения возникают примерно в 1,7% случаев (по результатам 2600 операций). Большинство осложнений характеризуется истечением спинномозговой жидкости через нос, параличом глазодвигательных нервов и потерей зрения.
При крупных секретирующих опухолях операции на гипофизе менее эффективны. У больных с уровнем пролактина в сыворотке выше 200 нг/мл или уровнем ГР выше 40 нг/мл концентрация гормонов после операции нормализуется лишь в 30% случаев. Операция эффективна примерно у 60% пациентов с болезнью Кушинга, обусловленной кортикотропной макроаденомой. Частота рецидивов при таких макроаденомах после хирургической ремиссии неизвестна: в случае пролактинсекретирующих опухолей частота рецидивов гиперпролактинемии составляет 10—80%.
Эффекты массы крупных опухолей также с трудом устраняются с помощью только оперативного лечения, В тех случаях, когда операция была единственным методом, симптомы болезни в течение 10-летнего периода возобновились у 85% больных. При сочетании операции с лучевой терапией частота рецидивов за 10 лет составила 15%.
Смертность при операциях по поводу макроаденом составляет около 0,86%, а осложнения встречаются примерно в 6,3% случаев. Из них почти в 5% случаев наблюдается транзиторный, а в 1% — постоянный несахарный диабет. К тяжелым осложнениям операции по поводу макроаденомы относятся также ринорея спинномозговой жидкости (3,3%), необратимая потеря зрения (1,5%), стойкий паралич глазодвигательных нервов (0,6%) и менингит (0,5%).
Лучевая терапия. После проведения традиционной лучевой терапии рост опухоли прекращается у 70—100%) больных, тогда как быстро нормализовать функцию гипофиза удается у гораздо меньшего их числа. Лечение проводится с применением ротационных методик и заключается в подведении к гипофизу 4500 сГр (4500 рад) за 4,5—5 нед. У 50% больных с акромегалией через 5 лет и у 70%) через 10 лет уровни ГР становятся ниже 5 нг/мл. Обычное облучение в качестве монотерапии редко позволяет достичь успеха в лечении взрослых больных с кортикотропными аденомами. Отдаленные результаты облучения больных с пролактиномами в настоящее время изучаются. Осложнения традиционной лучевой терапии характеризуются гипопитуитаризмом, который развивается почти у 50%) больных.
Облучение тяжелыми нуклидами — протонным пучком или альфа-частицами — эффективный метод лечения больных с секретирующими аденомами, но эффект этот наступает достаточно медленно. Опухоли с супраселлярным распространением или инвазией окружающих тканей подобным образом обычно не облучают. При облучении протоновым пучком на гарвардском циклотроне можно давать до 14 000 сГр (14 000 рад) без риска повредить окружающие структуры. Через 2 года у 28% больных с акромегалией уровень ГР был ниже 5 нг/мл, через 5 лет — у 56%, а через 10 лет — у 75%. Облучение протоновым пучком при болезни Кушинга через 2 года привело к устранению гиперкортизолемии у 55%, а через 5 лет— у 80%о больных. Воздействие на организм протоновым пучком эффективно снижает уровень АКТГ и останавливает рост большинства кортикотропных аденом у больных с синдромом Нельсона, за исключением тех случаев, когда опухоли к началу лечения уже прорастают окружающие ткани. Отдаленных результатов лечения пролактином с помощью протонного пучка пока нет.
Осложнения терапии тяжелыми частицами, включая гипопитуитаризм, встречаются не менее чем у 10%о больных; точных данных о развитии отдаленных осложнений нет. Примерно у 1,5%о больных отмечались обратимые дефекты полей зрения и глазодвигательные нарушения. Основной недостаток этого вида лечения заключается в значительной отсроченности нормализации секреции гормонов.
Для лечения микропролактином мы, как правило, применяем бромкриптин. Однако тем больным с микропролактиномами, которые нуждаются в лечении, но не переносят агонистов дофамина, мы рекомендуем оперативное вмешательство. При этом относительно доброкачественном заболевании операция обычно не приводит к гипопитуитаризму. У больных с акромегалией или болезнью Кушинга средством выбора мы считаем операцию, поскольку в большинстве случаев необходимо добиться достаточно быстрого прекращения гиперсекреции гормонов. Так как болезнь Кушинга и акромегалия потенциально смертельны, может потребоваться более обширная операция, приводящая к гипопитуитаризму.
Многие больные с макропролактнномами принимают только бромкриптин; эта схема лечения заслуживает внимания, и ее необходимо попытаться использовать. Транссфеноидальную операцию и/или лучевую терапию при крупных пролактиномах мы рекомендуем в случаях планирования беременности, наличия постоянных структурных нарушений или сохранения симптомов гиперпролактинемии, несмотря на прием агонистов дофамина, а также при непереносимости дофаминергических средств. Больным с нефункционирующими аденомами гипофиза при наличии структурных изменений требуется транссфеноидальная операция, как правило, с последующей традиционной лучевой терапией. Альтернативным методом лечения больных акромегалией или болезнью Кушинга, у которых имеются противопоказания к операции или которые отказываются от ее проведения, является облучение тяжелыми частицами. Воздействие на организм тяжелыми частицами или традиционное облучение эффективны в том случае, если после транссфеноидальной операции сохраняется повышенный уровень ГР. Облучение тяжелыми частицами эффективно также при сохранении болезни Кушинга. Облучение протоновым пучком успешно применяется при лечении большинства больных с синдромом Нельсона и может иметь преимущества перед традиционным облучением при лечении больных с макронролактиномамн и несекретирующими макроаденомами. Иногда, особенно при гигантских аденомах, требуется трансфронтальная операция.
Гипопитуитаризм. Гипопитуитаризмом называют недостаточность одного или более гипофизарных гормонов. Известно много причин гипопитуитаризма (табл. 321-6).
Недостаточность гипофизарных гормонов может быть врожденной и приобретенной. Часто встречается изолированная недостаточность ГР или гонадотропинов. Нередко имеет место и временная недостаточность АКТГ как результат длительной глюкокортикоидной терапии, но постоянная изолированная недостаточность АКТГ или ТТГ встречается редко. Недостаточность любого гормона передней доли гипофиза может обусловливаться патологией как гипофиза, так н гипоталамуса. При наличии несахарного диабета первичный дефект почти всегда локализуется в гипоталамусе или в верхних отделах ножки гипофиза; часто при этом наблюдаются также легкая гиперпролактинемия и гипофункция передней доли гипофиза.
Проявления гипопитуитаризма зависят оттого, недостаточность каких гормонов имеется в конкретном случае. Малорослость. обусловленная дефицитом ГР, — достаточно широко распространенный симптом у детей. Недостаточность ГР у взрослых лиц проявляется менее заметно — тонкими морщинками вокруг глаз н рта, а у больных сахарным диабетом — повышенной чувствительностью к инсулину. Недостаточность гонадотропинов характеризуется аменореей н бесплодием у женщин, признаками снижения уровня тестостерона, снижением либидо, уменьшением роста волос на подбородке п геле и сохранением детской линии оволосения головы — у мужчин. Недостаточность ТТГ сопровождается гипотиреозом с утомляемостью, непереносимостью холода н одутловатостью кожи в отсутствие зоба. Недостаточность АКТГ приводит к дефициту кортизола, проявляющемуся слабостью, потерей аппетита, снижением массы тела; уменьшению пигментированности кожи и грудных сосков; нарушению реакции на стресс (что характеризуется лихорадкой, гипотензией и гипонатриемией) и повышению смертности. В отличие от первичной недостаточности коры надпочечников (аддисонова болезнь) недостаточность АКТГ не сопровождается гиперпигментацией, гиперкалиемией или нарушением водно-солевого обмена. У больных с сочетанной недостаточностью АКТГ и гонадотропинов выпадают волосы под мышками и на лобке. У детей с комбинированной недостаточностью ГР н кортизола часто развивается гипогликемия. Дефицит АВП вызывает несахарный диабет с полиурией и усиленной жаждой. В тех случаях, когда аденомы гипофиза обусловливают дисфункцию его передней доли, в первую очередь нарушается секреция ГГ, а затем гонадотропинов. ТТГ н АКТГ.
Причины. Патология передней доли гипофиза связана обычно с аденоматозным ростом (с инфарктом или без него), операцией на гипофизе, его облучением тяжелыми частицами или инфарктом в послеродовом периоде (синдром Шихена). Послеродовой инфаркт гипофиза возникает в связи с тем, что увеличенная во время беременности железа особенно предрасположена к ишемии; послеродовое кровотечение с системной гипотензией в таких условиях может служить причиной ишемического инфаркта гипофиза. Первым и наиболее частым клиническим признаком является неспособность к лактации, тогда как другие симптомы гипопитуитаризма могут оставаться скрытыми в течение месяцев и лет. Это состояние иногда диагностируют спустя годы после инфаркта гипофиза. Хотя клинические
Таблица 321-6. Причины гипопитуитаризма
Изолированная недостаточность гормонов (врожденная или приобретенная) Опухоли (крупные аденомы гипофиза; апоплексия гипофиза; опухоли гипоталамуса, например краниофарингиомы, герминомы, хордомы, менингиомы, глиомы и др.) Воспалительные процессы [гранулемные заболевания, например саркоидоз, туберкулез, сифилис, гранулематозный гипофизит: гистиоцитоз X; лимфоцитарный гипофизит
(аутоиммунный)] Сосудистые заболевания (послеродовой некроз Шихена; ? околородовой диабетический некроз; аневризма сонной артерии) Деструктивно-травматические процессы [хирургическая операция; отрыв ножки гипофиза; облучение (традиционное — гипоталамус; тяжелыми частичами — гипофиз)] Пороки развития (аплазия гипофиза; энцефалоцеле основания мозга) Инфильтративные процессы (гемохроматоз; амилоидоз) «Идиопатические» случаи (? аутоиммунные процессы)
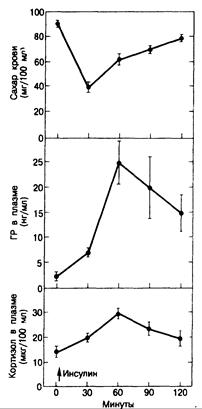
Рис. 321-8. Тест толерантности к инсулину.
После внутривенного введения обычного инсулина (0,1 ЕД/кг массы тела) ожидается падение уровня сахара в крови и повышение концентрации ГР и кортизола в плазме. Этот тест позволяет оцепить резервы как ГР, так и АКТГ у больных с заболеваниями гипофиза. (По К. J. Catt. Lancet, 1970, 1:933.)
проявления несахарного диабета в таких случаях редки, часто наблюдается снижение реакции АВП на соответствующие стимулы. Больные сахарным диабетом также предрасположены к развитию гипопитуитаризма на поздних стадиях беременности.
Другой причиной гипопитуитаризма является лимфоцитарный гипофизит — синдром, развивающийся обычно во время беременности или в послеродовом периоде. При этом синдроме КТ-сканирование часто позволяет обнаружить в гипофизе некую массу, которая при биопсии оказывается лимфоидным инфильтратом. Считают, что лимфоцитарный гипофизит представляет собой аутоиммунное разрушение гипофиза, которому часто сопутствуют другие аутоиммунные заболевания, такие как тиреоидит Хашимото (аутоиммунный) и атрофия слизистой оболочки желудка (см. гл. 334). У некоторых из таких больных в крови обнаруживаются антитела к пролактотрофам. Хотя выявлено всего меньше 20 случаев лимфоцитарного гипофизнта, антитела к пролактину присутствуют в сыворотке примерно 7% больных с другими аутоиммунными заболеваниями. Неясно, как часто аутоиммунный гипофизит служит причиной «идиопатического» гипопитуитаризма у взрослых лиц.
Повреждение гипоталамуса или ножки гипофиза может быть обусловлено многими причинами (см. табл. 321-6). Некоторые процессы в этой области, такие как саркоидоз, метастазы рака, герминомы, гистиоцитоз и краниофарингиомы, обычно вызывают не только гипофункцию передней доли гипофиза, но и несахарный диабет. Недостаточность гипофиза после обычного облучения мозга или гипофиза относят в основном на счет повреждения гипоталамуса.
Диагностика (см. табл. 321-5). При диагностике недостаточности ГР наиболее надежным стимулятором его секреции является инсулиновая гипогликемия, при которой уровень сахара в крови падает ниже 40 мг/дл (400 мг/л) (рис. 321-8). Если после эпизода гипогликемии, введения леводопы или аргинина концентрация ГР превышает 10 нг/мл. можно исключить наличие дефицита ГР. Определение базальных концентраций ГР или ИФР-1/СМ-С в сыворотке крови менее надежно, поскольку у здорового человека уровень ГР на протяжении большей части суток ниже предела чувствительности метода, а содержание ИФР-1/СМ-С у больных с недостаточностью ГР перекрывается нормальными величинами.
Недостаточность кортизола потенциально опасна для жизни. Базальный уровень кортизола может сохраняться, несмотря на выраженную патологию гипофиза; поэтому необходимо оценивать способность гипофиза увеличивать секрецию АКТГ в ответ на стресс. Для определения адекватности резервов АКТГ можно использовать тест толерантности к инсулину (инсулиновая проба) или метопироновый тест.
В амбулаторных условиях тест толерантности к инсулину без какой-либо опасности можно проводить лицам молодого или среднего возраста, не страдающим заболеваниями сердца и без предрасположенности к судорожным припадкам (см. рис. 321-8 и табл. 321-5). Определяют реакцию как ГР. так и кортизола. При подозрении на гипопитуитаризм следует вводить меньшие дозы обычного инсулина (0,05—0,1 ЕД/кг массы тела). После воспроизведения гипогликемии достаточной степени максимум концентрации кортизола в плазме должен превышать 19 мкг/дл (190 мкг/л), хотя предлагаются и другие критерии. Поскольку у больных с пониженной базальной скоростью секреции кортизола метопироновый тест может вызвать острую недостаточность надпочечников, его следует проводи ть в условиях клиники, когда базальная концентрация кортизола в сыворотке в 8 ч утра ниже 9 мкг/дл (90 мкг/л). Кроме того, введению метопирона у большинства больных должен предшествовать быстрый стимуляционный тест с АКТГ, позволяющий удостовериться в способности надпочечников реагировать на АКТГ. У больных с базальным уровнем кортизола в плазме в 8 ч утра 4—5 мкг/дл (40—50 мкг/л) метопироновый тест проводить нельзя. Нормальная реакция на введение метопирона (см. табл. 321-5) характеризуется возрастанием уровня 11-гидроксикортизола в плазме выше 10 мкг/дл, а содержания 17-гидроксистероидов в моче — не менее чем в 2 раза по отношению к базальному, обычно до величин, превышающих 22 мг за сутки. Уровень кортизола в плазме должен одновременно падать ниже 4 мкг/дл (40 мкг/л), чтобы быть уверенным в достаточности стимула для секреции АКТГ. Хотя реакции АКТГ на инсулиновую гипогликемию и метопирон недостаточно стандартизованы, нормальной считают пиковую концентрацию АКТГ выше 200 пг/мл.
Быстрый стимуляционный тест с АКТГ может быть более безопасным и удобным для проверки сохранности функции гипофизарно-надпочечниковой системы, нежели инсулинотолерантный или метопироновый тесты. Поскольку реакция надпочечников на экзогенный АКТГ зависит от предшествующего действия эндогенного АКТГ, у больных с резким дефицитом АКТГ в действительности снижается реакция надпочечников и на экзогенный АКТГ. Однако быстрый стимуляционный тест с АКТГ у некоторых больных с нарушенной инсулиновой пробой может оставаться нормальным и поэтому не выявлять всех тех, кто подвержен риску развития недостаточности надпочечников при стрессе. Таким образом, если тесты на секреторные резервы АКТГ выявляют нарушение в гипофизарно-надпочечниковой системе, то нормальная реакция на быстрый стимуляционный тес г с АКТГ [уровень кортизола выше 19 мкг/дл (190 мкг/л)] не всегда позволяет исключить такое нарушение.
Гонадотропную функцию гипофиза оценить легче. У женщин с регулярными менструациями секреция гонадотропинов заведомо нормальна, и определять эти гормоны излишне. Точно так же у мужчин с нормальным уровнем тестостерона в сыворотке крови и нормальным сперматогенезом не требуется определять содержание гонадотропинов. У женщин в постклимактерическом периоде уровень гонадотропинов повышен (эндогенный стимуляционный тест): «нормальный» их уровень в таких условиях свидетельствует о недостаточности гонадотропинов. Дефицит эстрогенов у женщин и тестостерона у мужчин без повышения содержания гонадотропинов и означает их недостаточность.
Для диагностики центрального гипотиреоза прежде всего следует определить уровень Т4 и свободного Т4 в сыворотке крови (или поглощение Т3 смолой и индекс свободного Т3). Если эти показатели соответствуют средним нормальным, то и ТТГ-функция нормальна. Если же содержание Т4 и свободного Т4 снижено, а уровень ТТГ в сыворотке не повышен, то имеет место центральный гипотиреоз. Диагноз легкого центрального гипотиреоза устанавливают у лиц с заболеванием гипофиза и уровнями Т4 и свободного Т4, находящимися на нижней границе нормы. Прежде чем ставить диагноз изолированной недостаточности ТТГ у больных с биохимическими признаками центрального гипотиреоза в отсутствие симптомов недостаточности других гипофизарных гормонов, необходимо исключить синдром недостаточности тироксинсвязывающего глобулина (ТСГ) (сниженный уровень Т4. повышенное поглощение Т3 смолой, низкий или на нижней границе нормы индекс свободного Т4, нормальный уровень ТТГ) и синдром «эутиреоидной патологии» (низкий уровень Т4, низкий уровень свободного Т4 или индекс свободного Т4, нормальное содержание ТТГ) (см. гл. 324).
Некоторые диагностические тесты для оценки гипофизарных резервов проводят с использованием гипоталамических рилизинг-гормонов. Хотя эти тесты не помогают оценить адекватность функции передней доли гипофиза, в ряде ситуаций они оказываются полезными. При дефиците ГР у детей реакция ГР на ГРГ позволяет выбрать метод лечения конкретного больного — с помощью ГРГ или ГР. Подобно этому, у больных с изолированной недостаточностью гонадотропинов реакция последних на ЛГРГ помогает спрогнозировать результаты лечения аналогами ЛГРГ. Тест с КРГ может быть полезным при дифференциальной диагностике синдрома Кушинга, но не позволяет выяснить, будет ли гипофизарно-надпочечниковая система должным образом реагировать на стресс. Стимуляционный тест с ТРГ у некоторых больных способствует подтверждению диагноза гипертиреоза или акромегалии, а также информативен в тех случаях, когда нужно документировать недостаточность пролактина, чтобы подтвердить диагноз более генерализованной недостаточности гормонов передней доли гипофиза (например, при легком центральном гипотиреозе). Тест с ТРГ не требуется для диагностики центрального гипотиреоза и недостаточно надежен для разграничения гипофизарного и гипоталамического гипотиреоза.
Лечение. Больным с пангипопитуитаризмом можно вводить недостающие гормоны, но наиболее важна заместительная терапия кортизолом. Исходя из соображений удобства и цены, мы предпочитаем преднизон, но многие врачи применяют кортизона ацетат. Преднизон (5—7.5 мг) или кортизона ацетат (20—37,5 мг) можно назначать одним больным в виде одноразовой утренней дозы, тогда как другие требуют дробных доз (две трети в 8 ч утра и одна треть в 3 ч yтpa). Больные гипопитуитаризмом нуждаются в меньших суточных дозах глюкокортикоидов, чем больные с аддисоновой болезнью, и не требуют заместительной терапии минералокортикоидами. В стрессовых ситуациях или в периоды подготовки таких больных к хирургическим операциям на гипофизе или других органах дозы глюкокортикоидов нужно увеличивать (например, при крупных операциях вводить гидрокортизона гемисукцинат в дозе 75 мг внутримышечно или внутривенно каждые 6 ч или метилпреднизолона натрия сукцинат в дозе 15 мг внутримышечно или внутривенно каждые 6 ч), У больных с центральным гипотиреозом наиболее эффективен левотироксии (0,1—0,2 мг в сутки). Поскольку тпроксии ускоряет распад кортизола и может вызвать адреналовый криз у больных с ограниченными резервами гипофиза, при пангипопитуитаризме лечению левотироксином всегда должна предшествовать заместительная терапия глюкокортикоидами. Женщин с гипогонадизмом лечат эстрогенами в сочетании с прогестагенами, мужчин — инъекциями эфиров тестостерона. Для обеспечения фертильности больным с заболеваниями гипофиза нужно инъецировать гонадотропины, а больным с патологией гипоталамуса могут помочь ЛГРГ и его аналоги. Дефицит ГР у взрослых не поддается коррекции; у детей обычно требуется введение ГР, но в случаях патологии гипоталамуса эффективными могут быть инъекции ГРГ. При несахарном диабете больным вводят десмопрессин через нос (обычно 0,05—0,1 мл дважды в сутки) (см. гл. 323).
Рентгенология гипофиза. Контуры турецкого седла видны на обычных рентгенограммах черепа в заднепередней и боковой проекциях (рис. 321-9). На таких снимках можно выявить увеличение, эрозии и кальцификации в области турецкого седла. Чтобы получить более детальное представление о внутригипофизарных и супраселлярных повреждениях, необходимо использовать КТ-сканирование и магнитную резонансографию (МРГ). В тех случаях, когда в качестве причины увеличения турецкого седла подозревают аневризму или сосудистую аномалию, выполняют ангиографию. Последняя иногда необходима и у больных с крупными опухолями гипофиза или гипоталамуса. Для получения изображения супраселлярной области вместо пневмоэнцефалографии все чаще используют цистернографию с метризамидом, т. е. КТ-сканирование производят после интратекальной инъекции водорастворимого красителя метризамида. Томография турецкого седла не рекомендуется, так как она очень часто даст ложноположительные и ложноотрицательные результаты, кроме того, хрусталики глаз подвергаются чрезмерной лучевой нагрузке. В конце концов современные методы исследования гипофиза могут быть вытеснены МРГ (рис. 321-10).
У больных с микроаденомами гипофиза объем турецкого седла (233—1092 мм3, в среднем 594 мм3) не меняется. При обычной рентгенографии микроаденомы можно заподозрить на основании очаговых эрозий или пузырьков на дне турецкого седла, но иногда подобная картина наблюдается и у здоровых лиц. Более крупные микроаденомы могут обусловливать «наклон» дна турецкого седла, видимый во фронтальной проекции, и «двойное дно» — в сагиттальной (рис. 321-11).
Поскольку при большинстве микроаденом объем турецкого седла не изменяется и отсутствуют специфические рентгенологические признаки, выявлять подобные опухоли необходимо при помощи КТ-сканирования с высоким разрешением (рис. 321-12). При КТ-сканированпи видно, что нормальный гипофиз имеет высоту 3—7 мм. Его верхний край плоский или вогнутый. Ножка гипофиза располагается по средней линии, и ее диаметр в аксиальной проекции составляет 4 мм. При внутривенном введении контрастного вещества нормальный гипофиз у 60% здоровых лиц выглядит гомогенным, а у 40° о — гетерогенным образованием. Почти у 20% здоровых лиц при КТ-сканировании с контрастным веществом в гипофизе видны отдельные участки пониженной плотности. При анализировании случайной выборки аутопсийного материала обнаруживают небольшие аномалии гипофиза (например, микроаденомы, кисты, метастазы рака, инфаркты) почти у 24% лиц,
Рис. 321 -9. Рентгенограмма турецкого седла (вид сбоку).
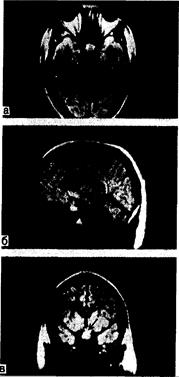
Рис. 321-10. Магниторезонансограммы (МРГ) больного с крупной аденомой гипофиза (показана стрелкой) в аксиальной (а), сагиттальной (б) и корональной (в) проекциях. (По G. Gerardetal.Hosp.Pract., 1984, 19:151.)
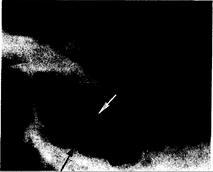
Рис. 321-11. Боковая КТ-сканограмма турецкого седла (в сагиттальной проекции).
Видно «двойное дно» из-за смещения его книзу под действием аденомы гипофиза. Верхней стрелкой показано нормальное дно; нижней стрелкой —дно. смещенное опухолью.
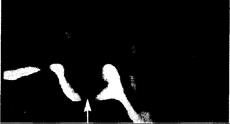
Рис. 321-12. КТ-сканограмма турецкого седла (в сагиттальной проекции) у больного с небольшой микропролактиномой (показана стрелкой.)
Опухоль обладает пониженной плотностью, видна незначительная эрозия дна турецкого седла. Опухоль показана стрелками.
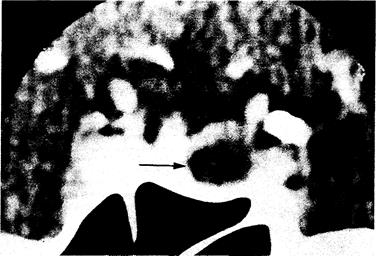
Рис. 312-13. КТ-сканограмма (в корональной проекции) у женщины в возрасте 30 лет.
Видна макропролактинома диаметром 1,3 см. Можно отметить пониженную плотность опухоли (стрелка). Ножка гипофиза смещена влево; дно турецкого седла также наклонено влево. но неизвестно, проявляются ли такие аномалии очаговыми изменениями при КТ-сканировании.
Микроаденомы лучше всего выявляются на прямых поперечных срезах, получаемых через 1 мм после быстрого введения контрастного вещества. Плотность нормального гипофиза повышена, но все же она меньше, чем плотность кавернозного синуса. Микроаденомы, особенно микропролактиномы, при исследовании этим методом выглядят обычно еще менее плотными (см. рис. 321-12). Особенно трудно увидеть мелкие кортикотропные аденомы. Более крупные микроаденомы могут обусловливать выпуклость диафрагмы турецкого седла вверх и контралатеральное смещение ножки гипофиза (рис. 321-13). Если выявлено выраженное увеличение интраселлярного пространства, то для исключения аневризмы или трансселяриого межкаротидного анастомоза необходимо провести ангиографию.
Макроадсномы гипофиза, как правило, вызывают увеличение турецкого седла с эрозией костей или без нее, что видно на обычных рентгенограммах. Однако наличия расширенного турецкого седла недостаточно для установления диагноза аденомы гипофиза (см. ниже). В качестве дополнительных признаков на плоских рентгенограммах черепа у больных акромегалией обнаруживают прогнатизм, увеличение параназальных пазух, гиперостоз наружного затылочного бугра, повышение плотности центральной кости турецкого седла и увеличение его площади с заострением бугорка. ГР-секретирующие аденомы могут подвергаться кальцификации и регрессировать, оставляя после себя гипофизарный камень. Более крупные кортикотропные аденомы приводят к опущению дна турецкого седла.
При КТ-сканировании у больных с макроаденомами в турецком седле обнаруживают массу, которая после введения контрастного вещества обычно приобретает большие размеры (см. рис. 321-5). Почти у 20% больных внутри этой увеличенной массы выявляют область с пониженной плотностью, что указывает на кистозную дегенерацию аденомы. Еще у 20% больных с макроаденомами турецкое седло частично пустое, причем плотность внутри него соответствует плотности СМЖ (см. ниже). Более крупные инвазивные опухоли могут распространяться в кавернозный синус, пазуху основной кости или в любую черепную ямку. Гиперплазия гипофиза (например, гиперплазия тиреотрофов при первичном гипотиреозе) при КТ-сканировании дает картину увеличенного заполненного турецкого седла, размеры которого после введения контрастного вещества не возрастают.
Апоплексию гипофиза вызывает внезапное увеличение размеров макроаденом вследствие кровоизлияния или ин4заркта. На плоскостных снимках почти всегда видно увеличение турецкого седла. В случае кровоизлияния при КТ-сканировании в острой фазе в аденоме обнаруживают область высокой плотности, а после рассасывания гематомы — низкой плотности с краевым увеличением или без него после введения контраста. При инфаркте видны области низкой плотности также с увеличением или без него после введения контраста.
Выявление на плоскостных рентгенограммах черепа на основании узелковой или криволинейной кальцификации в супраселлярной области позволяет заподозрить краниофарингиому (рис. 321 -14). Подобную кальцификацию обнаруживают у 80—90% больных детей, но менее чем у 50% взрослых больных. Хотя турецкое седло может быть увеличено и растянуто, кортикальная кость обычно сохраняется. При внутриселлярных краниофарингиомах спинка турецкого седла часто смещена назад. При КТ-сканировании почти у всех больных детей и у 80% взрослых больных отчетливо видны кистозные участки с кольцом узелковой кальцификации. Некистозные области после введения контрастного вещества так или иначе увеличиваются; у детей это особенно заметно.
Большинство менингиом области турецкого седла вызывают изменения, видимые на обычных рентгенограммах черепа. Это кальцификация опухоли и гиперостоз пластинки
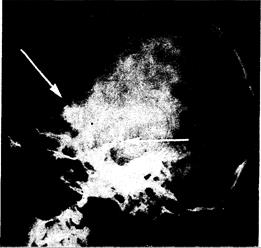
Рис. 321-14. Боковая рентгенограмма черепа (в боковой проекции)у больного с краниофарингиомой.
Можно видеть плотную кальцификацию в области, расположенной над турецким седлом (стрелка).
основной кости и борозды зрительного перекреста. Менингиомы могут также вызывать увеличение турецкого седла и тем самым имитировать картину аденом гипофиза. На КТ-сканограммах менингиомы иногда имеют вид аневризм в силу гомогенного увеличения их плотности после введения контрастного вещества. Для исключения аневризмы и визуализации питающих сосудов может потребоваться ангиография.
Аневризмы в области турецкого седла содержат концентрические кальцификаты, видимые на плоскостных рентгеновских снимках черепа почти у 30% больных. Аневризмы могут вызывать увеличение турецкого седла, обычно с латеральным опущением и эрозией его дна; поэтому в боковых проекциях видно «двойное дно». На КТ-сканограммах выявляют повышенную плотность аневризмы с гомогенным увеличением после введения контрастного вещества. Большинство больных с очень плотными образованиями, увеличивающими турецкое седло, требуют обследования с помощью методики количественного вычитания или обычной ангиографии. При тромбировании аневризмы картина на КТ может меняться: размеры новых тромбов не увеличиваются после введения контрастного вещества, тогда как старые увеличиваются подобно аденомам. Полный тромбоз аневризмы иногда невозможно рентгенологически отличить от аденомы гипофиза.
К видимым при КТ-скапировании увеличивающимся после введения контрастного вещества массам в супраселлярной области относятся глиомы перекреста зрительных нервов или гипоталамуса, метастазы в гипоталамус или ножку гипофиза, герминомы, сарко-идные гранулемы, гистиоцитоз, аневризмы и краниофарингиомы. К массам, не увеличивающимся после введения контрастного вещества, относятся дермоидные и эпидермоидные опухоли и кисты арахноидального пространства.
Увеличенное турецкое седло — синдром «пустого» турецкого седла. Увеличение турецкого седла могут вызывать аденомы гипофиза, гипоталамические массы и кисты, аневризмы, первичные гипотиреоз или гипогонадизм и повышение внутричерепного давления. Этот феномен встречается также у больных с синдромом первично «пустого» турецкого седла (рис. 321-15). В последнем случае турецкое седло обычно расширено симметрично без признаков костной эрозии. Супраселлярное субарахноидальное пространство выпячивается в виде грыжи через отверстия в диафрагме турецкого седла (см. рис. 321-15) так, что оно заполняется СМЖ, содержащейся в мешке из паутинной оболочки. Считается, что для этого необходимо нарушение целостности диафрагмы турецкого седла. Неясно, требуется ли транзиторное или постоянное повышение давления СМЖ для увеличения турецкого седла у таких больных, но уже при наличии этой патологии давление СМЖ, как правило, нормально. Гипофиз уплощен и сдвинут к одной из сторон, но функция его обычно не страдает. Подтвердить заполнение турецкого седла СМЖ можно результатами цистернографии с метризамидом, КТ-сканирования с высоким разрешением или МРГ.
Первично «пустое» турецкое седло важно отличать от увеличенного частично «пустого» седла вследствие дегенерации аденомы гипофиза. В первом случае объем гипофиза обычно в пределах нормы, а в последнем, как правило, увеличен. Подавляющее большинство больных с синдромом первично «пустого» турецкого седла — это тучные многорожавшие женщины, страдающие головными болями; примерно у 30% таких женщин имеется гипертензия. Интересно, что частые роды, ожирение и гипертензия сопровождаются повышением давления СМЖ. Среди имеющихся описаний случаев нельзя исключить некоторую направленность отбора, так как рентгенографию черепа производят при головных болях, а на этих рентгенограммах видят увеличенное турецкое седло. Симптомы со стороны эндокринной системы наблюдаются редко. Иногда имеет место гиперпролактинемия, возможно, вследствие пережатия ножки гипофиза или сопутствующих микропролактином. У таких больных из-за ожирения часто изменен секреторный резерв ГР. Примерно в 10% случаев наблюдалось спонтанное истечение СМЖ через нос и в 10% — псевдотумор головного мозга. Ринорея СМЖ нередко требует хирургической коррекции. Описаны отдельные случаи дефектов полей зрения; считают, что это связано с выпадением перекреста зрительных нервов в турецкое седло. Если диагноз синдрома «пустого» турецкого седла установлен с помощью КТ-сканирования, цистернографии с метризамидом или МРГ, то дальнейшие диагностические исследования излишни, и единственно, что требуется, — это успокоить больного.
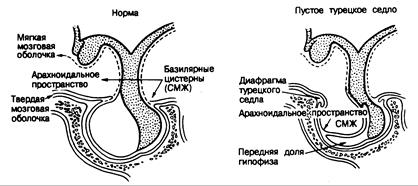
Рис. 321-15. Изменения, видимые у больных с синдромом «пустого» турецкого седла.
Слева показаны нормальные анатомические взаимоотношения. При синдроме «пустого» турецкого седла (справа) его расширение обусловлено выпячиванием арахноидального пространства через дефект диафрагмы седла. (По Jorden et al.)
Дата добавления: 2015-07-22; просмотров: 10363;
