Загальні відомості про процес горіння
Горіння – це хімічна реакція окислення, що супроводжується виділенням великої кількості тепла і звичайно світінням. Для виникнення процесу горіння потрібна наявність 3-х чинників:
– горючої речовини в будь-якому агрегатному стані;
– окислювача (кисень повітря, хлор, фтор, бром, оксиди азоту і т. д.);
– джерела загоряння (імпульсу).
Залежно від властивостей горючої суміші горіння може бути гомогенним і гетерогенним. При гомогенному горінні вихідні речовини мають однаковий агрегатний стан (наприклад, горіння газів). Горіння твердих і рідких горючих речовин є гетерогенним.
Горіння диференціюється також за швидкістю поширення полум'я і залежно від цього параметра може бути:
– дефлаграційним (в межах декількох м/с);
– вибуховим (порядку десятка м/с);
– детонаційним (тисячі м/с).
Пожежам властиве дефлаграційне горіння.
Залежно від співвідношення пального і окислювача розрізняють процеси горіння бідних і багатих горючих сумішей.
Бідними називають суміші, що містять в надлишку окислювач, їх горіння лімітується вмістом горючого компонента.
До багатих відносяться суміші з вмістом пального вищим за стехіометричне співвідношення компонентів. Горіння таких сумішей лімітується вмістом окислювача.
Виникнення горіння пов'язане з обов'язковим самоприскоренням реакції в системі. Існує три основні види самоприскорення хімічної реакції при горінні: тепловий, ланцюговий і комбінований ланцюжково-тепловий. Тепловий механізм прискорення пов'язаний з екзотермічністю процесу окислення і зростанням швидкості хімічної реакції з підвищенням температури за умови акумуляції тепла в реагуючій системі.
Ланцюгове прискорення реакції пов'язане з каталізом хімічних перетворень, що здійснюються проміжними продуктами перетворень і володіють особливою хімічною активністю, і називаються активними центрами. Відповідно до ланцюгової теорії хімічний процес здійснюється не шляхом безпосередньої взаємодії вихідних молекул, а за допомогою осколків, що утворюються при розпаді цих молекул (радикали, атомарні частинки).
Реальні процеси горіння здійснюються, як правило, по комбінованому ланцюгово-тепловому механізму.
Процес горіння характеризується самозайманням горючої суміші і самозайманням горючих речовин.
Температура самозаймання – це температура, при якій відбувається загоряння горючих речовин при підведенні тепла без зіткнення з джерелом відкритого вогню.
Встановлено, що процесу горіння завжди передує повільне окислення речовини. Під впливом зовнішнього джерела процес окислення прискорюється і швидкість теплоутворення перевищує швидкість тепловідведення.
Розрізняють ще процес самозагорання. Він аналогічний самозайманню з тією лише різницею, що самозагорання відбувається за рахунок біологічних або хімічних реакцій внутрішнього характеру, без надходження тепла ззовні.
Найбільше значення при оцінці пожежної безпеки горючих речовин мають температури, при яких горюча речовина підготовлена до горіння. Такими температурами є температура спалаху і температура займання.
Температурою спалаху називається найменша температура горючої речовини (рідкого), при якій створюється суміш газів або пари з повітрям, яка здатна запалати при піднесенні відкритого вогню. При цій температурі горючої речовини згорає тільки утворена при випарюванні (розкладанні) суміш пари (газів) з повітрям, але горіння самої речовини не відбувається.
Температурою займання називається найменша температура горючої речовини (рідини), при якій вона спалахує від відкритого джерела вогню або тепла і продовжує стійке, спокійне горіння після видалення цього джерела.
Відповідно до ГОСТ 12.1.004-85 під горючою рідиною(ГР) мається на увазі рідина, що здатна самостійно горіти після видалення джерела запалювання і котра має температуру спалаху більшу за +61°С.
Легко займиста рідина (ЛЗР) – це рідина, що здатна самостійно горіти після видалення джерела запалювання яка має температуру спалаху до +61°С.
Для ЛЗЖ різниця між температурами спалаху і займання дорівнює 1-2 °С, а для горючих рідин доходить до 30 °С.
Горючі гази, пара, пил (ацетилен, водень, СО, бензин, скипидар, кам'яновугільний пил і ін.) в суміші з киснем повітря здатні утворювати вибухові суміші.
Згідно з ГОСТ 12.1.010-80, вибух – надзвичайно швидке хімічне (вибухове) перетворення, що супроводжується виділенням енергії і утворенням стиснутих газів, здатних проводити механічну роботу. Вибух супроводжується звуком. Наприклад, при вибуху 250 гр. бензину розвивається потужність більш 10000 квт.
Умови вибуху:
– певна концентрація пило-, паро- або газоповітряної суміші;
– імпульс, здатний нагрівати речовину до температури самозаймання (полум'я, удар, адіабатичне стискання і ін.).
Вибухонебезпечні суміші характеризуються межами вибуху (таблиця. 11.1). Найменша концентрація пари, газів або пилу в повітрі, при якій можливий вибух, називається нижньою межею вибуху.
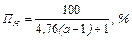 (11.1)
(11.1)
де а – кількість атомів кисню, необхідна для повного згорання молекули даної горючої речовини.
Таблиця 11.1. Межі вибуху деяких речовин
| Найменування речовини | ПН, % | ПВ, % |
| Бензин | 1,1 | 5,4 |
| Ацетилен | 1,5 | |
| Водень | 4,1 | |
| Метан | 5,0 | |
| Окисел вуглецю | 12,8 |
Подальше збільшення концентрації робить суміш вибухонебезпечною. Проте досягши якогось значення концентрації суміш стає невибухонебезпечною через нестачу окислювача. Така концентрація називається верхньою межею вибуху.
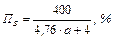 (11.2)
(11.2)
Всі концентрації між нижньою і верхньою межами є вибуховими і визначають діапазон вибуху. Чим більший діапазон, тим небезпечніша суміш.
Пожежонебезпечність речовин характеризується лінійною (вираженою в см/с) і масовою (г/с) швидкостями горіння (поширенням полум'я і вигорання (г/(м2 · с) або см/с)), а також граничним вмістом кисню, при якому ще можливе горіння. Для звичайних горючих речовин (вуглеводнів і їх похідних) це граничний вміст кисню і складає 12-14%, для речовин з високим значенням верхньої межі займання (водень, ацетилен, окисел етилену і ін.) граничний вміст кисню складає 5% і нижче.
Дата добавления: 2015-07-18; просмотров: 899;
