Биологическое действие и применение.
Соляная кислота активирует пищеварительный фермент пепсин, необходима для осуществления начальных стадий пищеварения. Стимулирует выделение секретов поджелудочной железы и печени, стимулирует перистальтику желудка и кишечника. Способствует всасыванию железа(II) из пищевого канала, оказывает противомикробное действие. Применяют внутрь только разведенную кислоту при анацидном и гипоацидном гастритах (совместно с пепсином), диспепсиях, гипохромной анемии (совместно с препаратами железа).
Препараты галогенидов.
К данной группе относятся:
- Natrii (Kalii) chloridum – хлорид натрия NaCl (калия) KCl;
- Natrii (Kalii) bromidum – бромид натрия NaBr (калия) KBr;
- Natrii (Kalii) iodidum – йодид натрия NaI (калия) KI.
Свойства: препараты представляют собой белые кристаллические порошки соленого вкуса легко растворимые в воде, бромиды и йодиды трудно растворимы в спирте, йодиды растворимы.
Галогениды натрия и калия имеют сходные физические свойства, способы получения и испытания препаратов, поэтому рассматриваются в одном разделе.
Получение.
Хлорид натрия (калия) получают из природных минералов (каменная соль, сильвинит (NaCl•KCl), карналлит (KCl•MgCl2•6H2O)).
Растворы минералов очищают от присутствующих в них примесей сульфат ионов и фосфатов ионов, осаждая их ионами бария:
Na2SO4 + BaCl2 → BaSO4↓ + 2NaCl
Na2HPO3 + BaCl2 → BaHPO4↓ + 2NaCl
Для удаления примесей ионов магния, кальция, бария, железа. Раствор обрабатывают избытком соды или поташи:
MgCl2 + Na2CO3  MgCO3 + 2NaCl
MgCO3 + 2NaCl
Для удаления избытка соды или поташи раствор нейтрализуют соляной кислотой до pH=7:
Na2CO3 + 2HCl → 2NaCl + H2O + CO2
Раствор упаривают до кристаллизации солей.
Бромиды и йодиды получают однотипно.
Железные опилки обрабатывают бромной водой, при этом железо окисляется до смешанных бромидов железа:
Fe + Br2 → FeBr2
3FeBr2 + Br2 → Fe3Br8
Раствор бромидов железа нагревают до кипения и прибавляют соду или поташ до щелочной реакции:
Fe3Br8 + 4K2CO3 + 4H2O → 4CO2 + 8KBr + Fe(OH)2↓ + 2Fe(OH)3↓
Отфильтровывают гидроксиды железа раствор, нейтрализуют до pH=7, упаривают до кристаллизации солей.
Подлинность.
Ион натрия (Na+) определяют по окрашиванию пламени горелки в желтый цвет.
При взаимодействии с цинк уранилацетатом в уксуснокислой среде – выпадение уранилацетата натрия цинка в виде желто-зеленого осадка:
NaCl + Zn[(UO2)3{CH3COO}8] + CH3COOH + 9H2O →
→ NaZn[(UO2)3{CH3COO}9]• 9H2O + HCl
Ион калия (K+) определяют по окрашиванию пламени горелки в фиолетовый цвет.
При взаимодействии с винной кислотой в присутствии ацетата натрия образуется белый осадок гидротартрата калия:
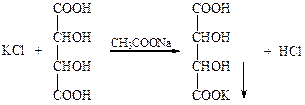
При взаимодействии с натрий гексанитрокобальтатом(III) образуется осадок гексанитрокобальтата(III) натрия калия желтого цвета:
2KCl + Na3[Co(NO2)6] → KNa2[Co(NO2)6] + NaCl
Определение ионов галогенов проводится по реакции с нитратом серебра:
хлорид серебра – белый осадок растворимый в разбавленном аммиаке;
бромид серебра – желтоватый осадок нерастворимый в разбавленном аммиаке, но медленно растворим в концентрированном растворе аммиака;
йодид серебра – желтый осадок нерастворимый в разбавленном и концентрированном аммиаке.
К раствору, содержащему анионы брома или йода, приливают хлороформ. Выделяющиеся при окислении галогенидов молекулярный бром или йод окрашивают хлороформный слой в бурый или фиолетовый цвета соответственно.
Количественное определение.
Для определения ионов хлора и брома применяется метод Мора:
KCl + AgNO3 → AgCl↓ + KNO3
2AgNO3 + K2CrO4 → Ag2CrO4 + 2KNO3
К раствору препарата прибавляют избыток раствора нитрата серебра, после выпадения осадка хлорида серебра. Оставшиеся в растворе катионы серебра оттитровывают хромовокислым калием, который также является индикатором (выпадение в осадок красно-кирпичного хромовокислого серебра). Метод применим для титрования нейтральных растворов, т.к. хромовокислое серебро растворимо при повышении концентрации протонов.
Для определения ионов йода (брома) применяется метод Фаянса:
KI + AgNO3 → AgI↓ + KNO3
При титровании ионов йода раствором азотнокислого серебра частицы осадка йодистого серебра заряжены отрицательно до тех пор, пока в растворе имеется избыток ионов йода. вблизи точки эквивалентности частицы осадка отдают адсорбированные ионы и после точки эквивалентности адсорбирую ионы серебра, приобретая положительный заряд. Если титрование проводить в присутствии флуоресцеина, наблюдается следующее. При отсутствии осадка флуоресцеин имеет желто-зеленую окраску и не изменяет ее до тех пор, пока в растворе имеется избыток ионов йода. Флуоресцеин – соединение кислотного характера – образует окрашенные анионы, которые не адсорбируются на отрицательно заряженных частицах осадка. После точки эквивалентности осадок приобретает положительный заряд, что вызывает адсорбцию красителя и приобретение осадком ярко-розового цвета.
Дата добавления: 2015-08-21; просмотров: 1120;
