Интенсивность реактора.
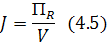
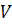 – объем реакционного пространства
– объем реакционного пространства
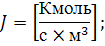
Интенсивность реактора 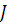 по сравнению с производительностью реактора
по сравнению с производительностью реактора 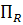 - является информационно емкой характеристикой оборудования, так как учитывает не только экстенсивный фактор (количество продукта в единицу времени), но и интенсивный фактор (количество вещества nR, образующегося в единицу времени в единице объема) – это аналог скорости реакции или процесса в целом.
- является информационно емкой характеристикой оборудования, так как учитывает не только экстенсивный фактор (количество продукта в единицу времени), но и интенсивный фактор (количество вещества nR, образующегося в единицу времени в единице объема) – это аналог скорости реакции или процесса в целом.
Выбор технологического режима. (ТР)
Технологический режим – это такая совокупность технологических параметров (Т,Р,С…), которая обеспечивает оптимальные условия эксплуатации технологического оборудования (реакционное оборудование).
1.а Выбор технологического режима на основании данных о химическом равновесии.
Химическое равновесие – раздел химической термодинамики.
Использование законов химического равновесия позволяют ответить на следующие основные вопросы, стоящие перед разработчиком реакционной аппаратуры:
1. Возможность самопроизвольного протекания процесса слева направо.
2. Каков возможный состав реакционной смеси в момент равновесия.
3. Определение или оценка тепловых эффектов 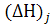 ; физических превращений: пар
; физических превращений: пар  .
.
Рассмотрим 1 пункт оценка самопроизвольного протекания процесса – используют величину свободной энергии Гиббса: 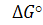 (кДж/кмоль)
(кДж/кмоль)
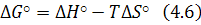
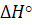 - тепловой эффект
- тепловой эффект
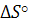 - изменение энтропии
- изменение энтропии
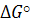 < 0 реакция протекает слева направо, самопроизвольные реакции.
< 0 реакция протекает слева направо, самопроизвольные реакции.
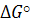 > 0 реакция не может протекать самопроизвольно слева направо.
> 0 реакция не может протекать самопроизвольно слева направо.
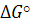 = 0 состояние химического равновесия
= 0 состояние химического равновесия
Для реакции:
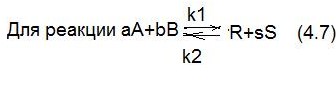
В случае наступления момента химического равновесия скорость прямой и обратной реакции равны.
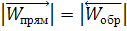
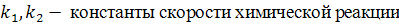
Тогда скорость прямой и обратной реакции:
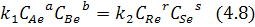
Проведем тождественное преобразование:
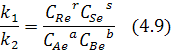
Из закона действующих масс:
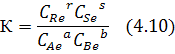
Константа равновесия характеризует состав реакционной смеси в момент равновесия:
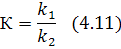
Константа равновесия определяется частным от деления произведения концентрации продуктов реакции (в соответствующих степенях) численно равных соответствующим значениям стехиометрических коэффициентов на произведение концентрации исходных реагентов в момент равновесия и возведенных в соответствующие степени.
Выражение константы равновесия через парциальные давления 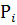 . Для перехода от
. Для перехода от  (для газовых реакций) используют закон Дальтона:
(для газовых реакций) используют закон Дальтона:
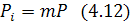
∑Pi=P
P – общее давление;
m – мольная доля.
Для реакции синтеза аммиака (1.1):
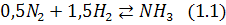
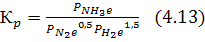
Связь константы равновесия с температурой.
Какой состав реакционной смеси следует ожидать на выходе из реакции.
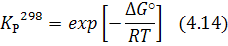
Кр связана с величиной ΔG 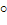 по уравнению изотермы Вант-Гоффа.
по уравнению изотермы Вант-Гоффа.
Пример 4.2
Определить константу равновесия при температуре 700 К реакции синтеза аммиака (1.1), протекающей в колонне синтеза (2.2), если
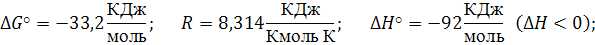
Уравнение изобар Ван-Гоффа:
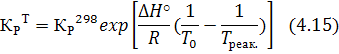
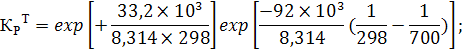
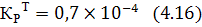
С ростом температуры константа равновесия резко падает, так как химическое равновесие смещается влево; без катализатора такая реакция не осуществима в практических условиях.
Дата добавления: 2015-08-21; просмотров: 2004;
