Почвенные коллоиды. строение, свойства и состав почвенных коллоидов
Накопление в почве элементов питания растений связано с поглотительной способностью почв. Академик К. К. Гедройц предложил под поглотительной способностью почвы понимать способность ее поглощать жидкости, газы, солевые растворы и удерживать твердые частички, а также живыемикроорганизмы. Поглотительные процессы в почве обусловлены преимущественно тонкодисперсной частью почвы и особенно коллоидами. Содержание коллоидов в почве редко превышает 30 % почвенной массы, но влияние их на свойства почвы и уровень плодородия исключительно велико.
Почва состоит из частиц различного размера. Почвенными коллоидами называют частицы диаметром от 0,2 до 0,001 мкм. Они образуются при диспергировании (раздроблении) крупных частиц или при конденсации вследствие физического или химического соединения молекул.
По происхождению почвенные коллоиды бывают минеральные, органические и органо-минеральные.
Минеральные коллоиды образуются при выветривании горных пород. Это глинистые минералы, коллоидные формы кремнезема и полуторные оксиды.
К органическим коллоидам относятся гумусовые вещества почвы, сформированные в процессе гумификации растительных и животных остатков.
Органо-минеральные коллоиды образуются при взаимодействии минеральных и органических коллоидов.
В различных почвах содержание коллоидов составляет от 1...2 до 30...40 % массы почвы. Наибольшее количество коллоидов отмечено в глинистых и суглинистых почвах с высоким содержанием гумуса, наименьшее — в песчаных и супесчаных почвах, бедных гумусом.
Строение коллоидной частицы (мицеллы). На рисунке показано строение коллоидной мицеллы. Ядро мицеллы — это внутренняя ее часть, состоящая из недиссоциированных молекул. Оно может быть аморфным или кристаллическим. На поверхности ядра находится двойной электрический слой ионов, соприкасающийся с дисперсной средой (почвенным раствором): внутренний — потенциал определяющий слой неподвижных ионов, прочно связанных с ядром, и внешний — компенсирующий слой ионов, имеющий противоположный заряд.
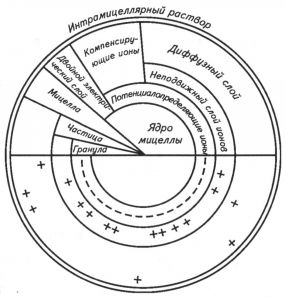
Рис. Схема строения коллоидной мицеллы (по Н. И. Горбунову)
Заряд коллоидной мицеллы определяют ионы, непосредственно связанные с поверхностью ядра. Этот заряд возникает в результате диссоциации молекул на поверхности ядра. Например, молекулы гидроксида алюминия Аl(ОН)з, составляющие ядро мицеллы, в кислой среде диссоциируют на ионы Al(OH)2+ и ОН-, а в щелочной — на АlO(OН)2- и Н+. Сложные ионы удерживаются на поверхности ядра и определяют знак заряда коллоидной мицеллы. Поэтому коллоидная частица гидроксида алюминия в кислой среде имеет положительный заряд, а в щелочной — отрицательный.
Коллоиды, имеющие кристаллическое строение, приобретают заряд иным путем. Известно, что ионы кристаллических частиц, находящиеся на поверхности, не насыщены связями и поэтому могут притягивать ионы из растворов. При этом притягиваются ионы противоположного заряда, вследствие чего образуется диффузный слой коллоидной мицеллы.
Ядро мицеллы и потенциалопределяющий слой ионов образуют гранулу. За потенциалопределяющим слоем гранулы расположены компенсирующие ионы. Прочносвязанные ионы этого слоя образуют неподвижный слой компенсирующих ионов. Затем следует внешний, или диффузный, слой ионов, способных обмениваться на ионы почвенного раствора. Таким образом, коллоидная мицелла состоит из ядра и двух противоположно заряженных слоев ионов.
Почвенные коллоиды по знаку заряда потенциал определяющего слоя подразделяются на отрицательные (ацидоиды) и положительные (базоиды). К отрицательным коллоидам относятся кремниевая кислота, глинистые минералы и гумусовые кислоты, к положительным — гидроксиды железа и алюминия.
Потенциал почвенных коллоидов зависит от их природы и реакции среды. Поскольку почвенные частицы имеют заряд, они способны притягивать дипольные молекулы воды из окружающего раствора, образуя гидратные пленки. Толщина этой пленки зависит от величины заряда. В связи с этим различают гидрофильные коллоиды (кремниевая кислота, гумусовые кислоты), удерживающие многослойные пленки воды, и гидрофобные, то есть слабогидратированные коллоиды (гидроксид железа, каолинит). Гидрофильные коллоиды имеют сродство с водой и способны сильно набухать, что предотвращает их слипание. Гидрофобные коллоиды набухают слабо, поэтому у них выражена способность свертываться и выпадать в осадок.
Коагуляция и пептизация коллоидов. Коллоиды могут находиться в двух состояниях: золя (коллоидного раствора) и геля (коллоидного осадка).
Коагуляцией называется процесс перехода коллоидов из состояния золя в состояние геля. Слипание коллоидов в агрегаты происходит под влиянием электролитов. Коагуляция ацидоидов вызвана катионами электролита, базоидов — анионами. Свертывание (слипание) коллоидов может происходить при взаимодействии противоположно заряженных коллоидных систем. При высушивании или замораживании почвы наблюдаются дегидратация (обезвоживание) гидрофильных коллоидов и повышение концентрации электролита почвенного раствора, что также вызывает коагуляцию коллоидов.
При коагуляции коллоидов происходит склеивание элементарных почвенных частиц в комочки, в результате чего улучшаются физические свойства почвы. Коагуляцию вызывают двухвалентные катионы, особенно Са2+. Кальций называют «стражем почвенного плодородия», так как он способствует образованию структуры и уменьшает кислотность почв.
Пептизация — это обратный процесс коагуляции, при котором коллоиды переходят из геля в золь. Пептизация происходит при воздействии растворов щелочных солей. Например, под влиянием одновалентного катиона натрия наблюдается усиленная гидратация коллоидов и переход их в состояние золя. При пептизации почвенных коллоидов разрушается ценная структура и ухудшаются свойства почвы. Так, столбчатый горизонт солонцовых почв, насыщенный гидратированными катионами натрия, во влажном состоянии набухает, а при высыхании растрескивается на крупные отдельности.
Роль коллоидов в почве исключительно велика: от содержания коллоидной фракции зависят связность, водопроницаемость, буферность и другие свойства почвы.
Источник:http://www.zoodrug.ru/topic3543.html
39. Почвенный поглощающий комплекс. Насыщенные и ненасыщенные основаниями почвы. Кислотность и буферность почв.
Материальным носителем обменной способности почв является почвенный поглощающий комплекс (ППК) — совокупность минеральных, органических и органо-минеральных соединений высокой степени дисперсности, нерастворимых в воде и способных к обменным реакциям. Поглотительной способностью обладала коллоидные частицы (0,001—0,200 мкм) и в меньшей степени предколлоидная фракция (0,2—1,0 мкм). Основным механизмом обменной поглотительной способности почв является процесс сорбции. Природа и состав ППК связаны с типом почвообразования. Общее количество поглощенных (обменных) катионов называется емкостью поглощения, или емкостью катионного обмена (ЕКО). Она зависит от содержания в почве илистой фракции, природы ППК и реакции среды. Емкость катионного обмена больше в почвах тяжелого гранулометрического состава, чем в легких. Органические коллоиды обладают более высокой ЕКО, чем минеральные. Минеральные коллоиды в почвах, содержащих монтмориллонит, характеризуются большим ЕКО, чем в почвах с преобладанием каолинита и гидрослюд. В обменной форме находятся многие макро — и микроэлементы минерального питания растений. Наиболее важны для диагностики процессов почвообразования и плодородия почв обменные катионы почвенного поглощающего комплекса: Са2+, Mg2+, Na+, Н+, Аl3+.
Кислотность почвы,одно из важнейших свойств многих почв, обусловленное наличием водородных ионов в почвенном растворе, а также обменных ионов водорода и алюминия в почвенном поглощающем комплексе. Повышенная К. п. отрицательно влияет на развитие растений и многих полезных микроорганизмов. Различают 2 формы К. п.: актуальную, или активную, — кислотность почвенного раствора, почвенной суспензии или водной вытяжки из почв, и потенциальную, или пассивную, "скрытую", — кислотность твёрдой фазы почвы. Актуальная К. п. обусловлена наличием ионов водорода. Выражается условной величиной pH (отрицательный логарифм концентрации водородных ионов); при pH 7 реакция почвенного раствора нейтральная, ниже 7 — кислая; чем ниже числовое значение рН, тем выше К. п. Потенциальную К. п. делят на обменную и гидролитическую. Обменная К. п. вызывает значительное подкисление почвенного раствора при взаимодействии почвы с нейтральной солью, что наблюдается при внесении физиологически кислых удобрений (хлористый калий, сернокислый аммоний и др.). По представлениям русского учёного К. К. Гедройца и некоторых других исследователей, обменная К. п. обусловлена присутствием в твердой фазе почвы ионов водорода, не вытесняемых нейтральными солями из поглощаемого комплекса, но способных к замещению (обмену) на другие катионы при обработке почвы растворами щелочей или гидролитически щелочных солей (например, раствором ацетата натрия, который и применяется при определении гидролитической кислотности). Степень К. п. необходимо учитывать при выборе минеральных удобрений, подготовке их перед внесением в почву. Основной способ борьбы с повышенной К. п. — известкование почв
Буферность почвы
свойство почвы препятствовать изменению её реакции (pH) под действием кислот и щелочей. Чем больше в почвенном растворе солей сильных оснований и слабых кислот, тем более буферна почва по отношению к кислым удобрениям; соли слабых оснований и сильных кислот буферны к щелочным удобрениям. Так как раствор находится в постоянном взаимодействии с твёрдой фазой почвы, то последняя также оказывает существенное влияние на буферность. Чем больше коллоидных частиц и гумуса в почве (например, чернозёмы) и чем больше они содержат поглощённых оснований, тем буфернее почва по отношению к кислым удобрениям; поглощённый коллоидами водород (подзолистые почвы, краснозёмы) способствует увеличению Б. п. к щелочным удобрениям. Наиболее буферны почвы тяжёлого (глинистого) механического состава. Атмосферные осадки, грунтовая и оросительная вода могут изменить реакцию почвы, если последняя не обладает буферностью, и наоборот. Растения реагируют на изменение реакции почвы, поэтому Б. п. играет большую роль в их росте и развитии. Б. п. можно повысить внесением органических удобрений
40. систематика почв, ее цели и задачи. Таксономия почв. Номенклатура почв и диагностика почв.
Дата добавления: 2015-06-27; просмотров: 7729;
