Состояние в водных растворах
В реальных условиях состав и устойчивость комплексных соединений зависят от среды, свойств лигандов и их концентраций, энергии связи с центральным атомом, которой соответствует усредненный спектрохимический ряд для многих металлов:
I- < Вг- <СГ < NO3- < F- < ОН- < Н2O < NCS- < NH3 < NO2- < CN- .
В этом ряду при движении слева направо усиливается способность ионов к вытеснению из внутренней сферы комплекса ионов, стоящих левее. Этот ряд не абсолютен, в нем могут быть и отклонения по вышеуказанным причинам, отсутствуют анионы многоосновных кислот (сульфат, фосфат), которые в большинстве случаев обладают повышенной способностью к комплексообразованию.
В водных растворах катионы металлов всегда гидратированы, поэтому образование в них комплексов определяется способностью соответствующего лиганда вытеснять воду из внутренней координационной сферы. При этом необходимо учитывать, что концентрация лиганда всегда будет меньше концентрации воды в несколько раз.
Анионы кислот, стоящих в спектрохимическом ряду правее воды, вытесняют ее, образуют, например, комплексный катион [GaSO4]+.
Состояние ионов галлия в водных растворах в значительной степени определяется комплексообразованием с молекулами воды и ионами гидроксила, которые относятся к числу лигандов, обладающих способностью к образованию прочных комплексов. Для комплексов галлия в растворах характерно координационное число 4, но с данными лигандами реализуются также и координационные числа 5 и 6.
Гидролиз солей галлия в разбавленных растворах становится заметным при рН 2–3 и может быть описан уравнениями:
[Ga(H2О)6]3+ → [Ga(OH)(H2О)5]2+ + Н+;
[Ga(OH)(H2О)5]2+ → [Ga(OH)2(H2О)4l+ + Н+.
Завершается гидролиз образованием комплекса [Ga(OH)4]-, ступенчатые константы образования гидроксокомплексов соответственно равны К1 = 2·10-3; К2 = 3,2·10-4; К3 = 4·10-5; К4 = 2·10-7. На рисунке 4.1 показано распределение ионных форм галлия в зависимости от рН раствора, которое в достаточной мере объективно отражает общие тенденции протекающих в системе процессов. Из него следует, что образованию Ga(OH)3 соответствует интервал значений pH 4–6, а при рН 6–10 интенсивно идет образование доминирующего анионного комплекса [Ga(OH)4]-.
Свежеосажденный Ga(OH)3 плохо растворяется в воде (ПР = 1,4·10-34), но растворяется в разбавленных растворах кислот, щелочей и аммиаке. Сопоставление констант диссоциации по кислотному и основному механизмам:
Ga(OH)3 + H2О → Н+ + H2GaO3- Ka1 = 1,2·10-7;
Ga(OH)3 → OН- + Ga(OH)2+ Kb1 = 3,2·10-8;
показывает, что кислотные свойства Ga(OH)3 выражены сильнее, чем основные. Для технологии очень важно, что гидроксид галлия является более сильной кислотой, чем гидроксид алюминия, а растворы галлатов устойчивее соответствующих алюминатов.
Другой особенностью ионов галлия является их склонность к гидролитической полимеризации. Мономерные ионы галлия существуют только при концентрации < 1 ммоль/л. Из растворов с концентрацией галлия больше < 1 ммоль/л. выпадают белые гелеобразные осадки гидроксида галлия, состав которых сильно зависит от условий осаждения: концентрации раствора, температуры и др. При осаждении образуются полиядерные комплексы, в которых атомы галлия связаны между собой через мостиковые гидроксогруппы. Первоначально образовавшиеся линейные полимеры в дальнейшем таким же образом объединяются в двумерные и к моменту образования осадка — в трехмерные. При старении осадка гидроксомостики могут превращаться в оксомостики, что снижает его реакционную способность.
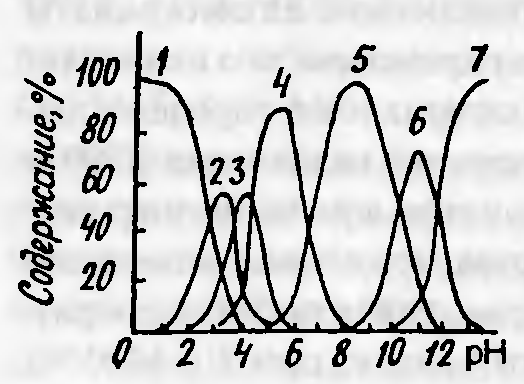
Обозначено: 1– [Ga(H2О)6]3+;2– [Ga(OH)(H2О)5]2+; 3– [Ga(OH)2(H2О)4]3+ 4– Ga(OH)3; 5– [Ga(OH)4]-; 6– [Ga(OH)5]2-;7– [Ga(OH)6]3-.
Рисунок 4.1 — Распределение гидроксокомплексов галлия в зависимости от рН раствора.
Сложность изучения гидролиза соединений Ga связана с возможностью существования различной координации ионов галлия одновременно: [Ga2(OH)2(H2O)2]2+ (к. ч. 4), [Ga2(OH)8]2- (к. ч. 6). Поэтому состав гелеобразных осадков гидроксид-оксидов галлия условно обозначают как гидраты Ga2О3·nH2О.
Осаждение гидроксидов галлия происходит как при нейтрализации растворов солей щелочами (рН 3,0–9,7), так и из растворов галлатов при действии на них растворов кислот (рН 9,7–4,1). Старение осадков под растворами, высушивание на воздухе и нагревание приводят к образованию продуктов различного состава:
– мелкокристаллический Ga(OH)3 образуется при 20°С;
– нагревание до 400°С или обработка под давлением при 150–160°С приводит к образованию гидроксид-оксида Ga(O)OH;
– полное обезвоживание происходит при 550°С.
В щелочных растворах осаждение галлия заканчивается при рН 9,7 при добавлении 2,8 моль щелочи. В то же время уже при рН 9,8 осадок начинает растворяться. В щелочной среде галлий находится преимущественно в виде комплекса [Ga(OH)4]- независимо от концентрации галлия, щелочи и их соотношения (рисунок 4.1).
Галлатные растворы более стабильны по сравнению с аналогичными алюминатными. Ион [Ga(OH)4]- по сравнению с ионом [Al(OH)4]- меньше склонен к полимеризации, и только при очень высоких концентрациях галлия и низких содержаниях щелочи образуется небольшое количество димеров [(OH)3GaОGa(OH)3]2-, а его растворы являются истинными, а не коллоидными.
При увеличении концентрации щелочи растворимость Ga(OH)3 сначала увеличивается, а затем уменьшается (рисунок 4.2). Упаривая растворы заданного состава со щелочными металлами, можно получить гидраты галлатов, а после обезвоживания и прокаливания — безводные кристаллические галлаты. Галлаты большинства других металлов либо плохо растворимы щелочноземельные), либо практически совсем не растворяются (РЗЭ и др.)..
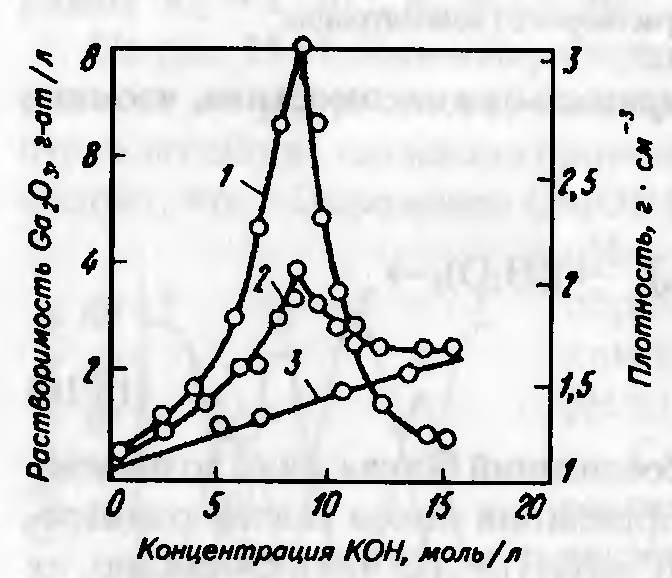
Обозначено: 1– концентрация галлия;2– плотность растворов галлата калия; 3– плотность растворов гидроксида калия-.
Рисунок 4.2 — Растворимость в системе Ga2O3 – K2O – H2O (20°С).
В водных растворах индий преимущественно присутствует в степени окисления III. Гидроксид In(ОН)3 получается в виде белого студенистого осадка при действии щелочей или аммиака на растворы солей индия. Из разбавленных растворов гидроксид индия начинает осаждаться при рН~3,4. В присутствии комплексообразователей (ацетаты, галогениды щелочных металлов) рН начала осаждения возрастает.
С повышением рН в растворе ускоряется процесс гидролитической полимеризации, например в хлоридных растворах первоначально возникшие [In(OH)Cl]+ полимеризуются в [In2(ОН)2С1]2+ и при дальнейшем гидролизе дают [In3(ОН)4]5+. Полиядерным центрам приписывается состав In[(OH)2In]nn+3. Состав гидроксокомплексов индия зависит от рН и ионной силы раствора (рисунок 4.3).
Выпавший осадок первоначально отвечает составу основной соли In4(OH)10SO4 или In5(ОН)14Сl, которые затем переходят в гидроксид индия. Для получения гидроксида без примеси основных солей рекомендуют осаждать его аммиаком из раствора нитрата индия, подкисленного уксусной кислотой. Повышение температуры снижает рН начала осаждения. Произведение растворимости гидроксида индия составляет 1,41·10-33.
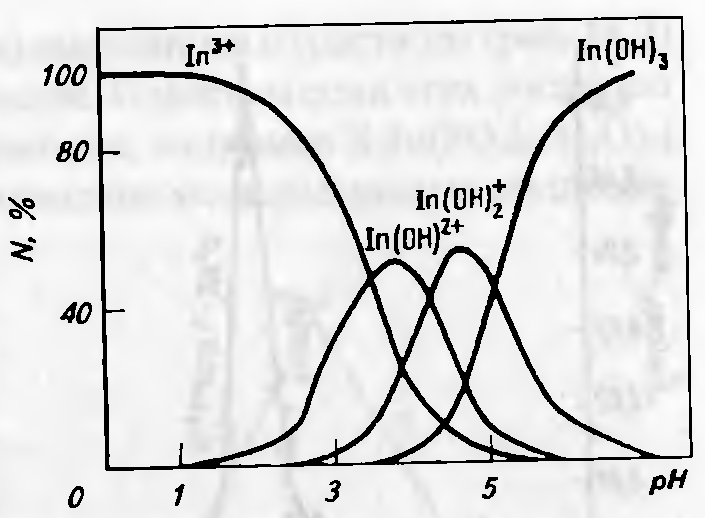
Рисунок 4.3 — Распределение гидроксокомплексов индия в зависимости от рН раствора.
Первоначально аморфные осадки In(ОН)3 быстро стареют и становятся кристаллическими без изменения состава. Высушивание осадков при температуре до 150°С приводит к потере только адсорбированной воды. Полное разложение гидроксида до In2O3 происходит при 200–350 °С.
Свежеосажденный гидроксид индия легко растворяется в разбавленных минеральных, а также в уксусной, муравьиной и винной кислотах. Он обладает амфотерными свойствами, однако его кислотные свойства выражены слабее, чем у гидроксида галлия. Разбавленные растворы щелочей, а также аммиак на гидроксид индия не действуют. Концентрированные растворы щелочей (выше ~ 20%) растворяют гидроксид индия с образованием индатов. Из щелочных растворов с концентрацией -12 моль/л были выделены кристаллические гексагидроксоиндаты натрия и калия состава М3[In(ОН)6]·2Н2O. При меньших концентрациях щелочи растворы индатов неустойчивы — гидролизуются, выделяя часть растворенного гидроксида индия (рисунок 4.4). В этом проявляются слабые амфотерные свойства индия.
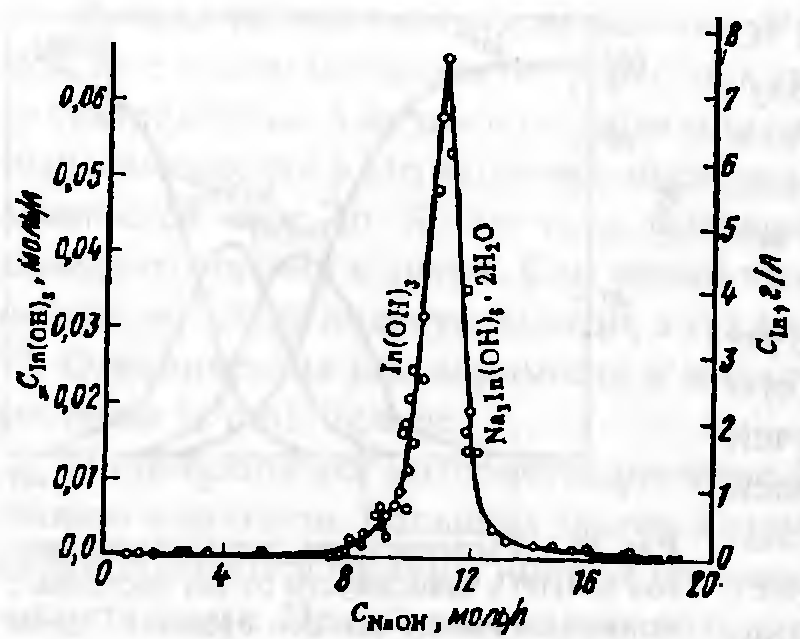
Рисунок 4.4 — Растворимость в системе In2O3 – Na2O – H2O (25°С).
Нормальный электродный потенциал системы Т13+/Т1+ = 1,25 В, что указывает на большую устойчивость в водных растворах иона Т1+ и на сильные окислительные свойства иона Т13+. Поведение последнего довольно сильно зависит от рН и присутствия в растворе ионов-комплексообразователей. Например, в присутствии 1 моль/л хлорид ионов указанный потенциал становиться равным 0,77В, что указывает на стабилизацию Т13+.
В растворе можно окислить таллий(I) до таллий(III) только сильными окислителями: персульфатами калия и аммония, парманганатом калия, броматом калия, хлорной и бромной водой и др. Пероксид водорода окисляет таллий(I) как в кислой, так и щелочной среде, в которой окисление протекает быстрее.
Металлический таллий можно получить электролизом водных растворов его солей, но электролиз осложняется образованием в анодном пространстве ионов Т13+ и выпадением осадка Т12О3. Таллий (I) в соответствии с его нормальным потенциалом -0,34 В можно цементировать из кислых растворов Zn, Al, Mg. При совместном присутствии с другими металлами он осаждается после меди и олова перед кадмием.
С водой Tl2O образует гидроксид. Гидроксид TlОН — желтые игольчатые кристаллы, которые легко темнеют вследствие разложения. Гидроксид хорошо растворим в воде. Проявляет сильные щелочные свойства, хотя и уступает по силе КОН, жадно поглощает СО2 из воздуха, разъедает стекло и фарфор, осаждает гидроксиды меди, цинка и других металлов из растворов их солей.
Гидроксид таллия(III) Т1(ОН)3 — очень нестойкое соединение; его не удается получить стехиометрического состава. При действии щелочи или аммиака на растворы солей таллия (III) при рН от 2 до 4,5, выпадает бурый осадок гидрата оксида таллия(III) (рисунок 4.5). Состав его отвечает формуле Т12О3·nН2О. В отличие от галлия и индия основные соли при этом не образуются. Вода в гидрате не связана в стехиометрических количествах, хотя и удерживается сравнительно прочно. Обезвоживается гидрат плавно, без каких-либо ступеней.
Он обладает амфотерными свойствами, выраженными несколько сильнее, чем у In(ОН)3. На рисунке 4.5 приведена диаграмма растворимости системы гидрат Tl2O3 – Na2O – H2O при 20 °С За эвтонической точкой раствор находится в равновесии с белым осадком таллата натрия [Na3Tl(OH)6].

Рисунок 4.5 — Растворимость в системе Tl2O3 – Na2O – H2O (20°С).
Дата добавления: 2015-06-22; просмотров: 3050;
