Химические свойства бериллия и его важнейших химических соединений
МЕТАЛЛУРГИЯ БЕРИЛЛИЯ
История открытия бериллия
Бериллий был открыт в 1798 году французским химиком Луи Никола Вокленом при анализе изумруда и берилла, о чем он 15 февраля сделал доклад на заседании французской Академии наук. Открытый элемент Воклен предложил назвать «глицинием» (Gl) из-за сладковатого привкуса его солей (от греческого γλυκύς — сладкий). Сейчас это название сохранилось лишь во Франции, а в других странах за элементом закрепилось имя «бериллий», предложенное известными химиками М. Клапротом и А. Экебергом по названию минерала,в котором он был обнаружен — берилла.
Судьба этого элемента во многом сходна с судьбами его собратьев-металлов. В свободном виде он был выделен в 1828 году Ф. Вёлером и независимо А. Бюсси, но лишь спустя семь десятилетий француз П. Лебо электролизом расплавленных солей смог получить чистый металлический бериллий.
Химические свойства бериллия и его важнейших химических соединений
Элементы IIa группы Периодической системы во внешнем электронном уровне содержат два электрона. Из них редкими металлами являются бериллий и стронций. Общим свойством для них является способность образовывать двухзарядные катионы, имеющие электронную структуру благородного газа. Степень окисления (I) для этих элементов практически не реализуется, что сильно упрощает их химию. Отрыв третьего электрона требует очень большой энергии (таблица 3.1), поэтому степени окисления выше (II) для этих металлов также не существуют.
При взаимодействии с другими атомами валентные возможности щелочноземельных металлов могут реализоваться следующими способами:
– возбуждение одного из s-электронов на p-подуровень, приводящее к sp-гибридному состоянию орбиталей с последующим образованием двух ковалентных связей;
– полная потеря двух электронов с переходом в ионное состояние M2+ с последующим электростатическим взаимодействием катионов с анионами и молекулами;
– использование вакантных р- и d-орбиталей для образования связей по донорно-акцепторному механизму.
В реальных соединениях осуществляются все три типа взаимодействия с преобладанием одного из них в зависимости от природы партнера. Для легких элементов (Be, Mg), у которых энергии ионизации велики, в механизме образования связи преобладает вклад ковалентной составляющей. Для стронция, бария и радия, особенно в соединениях с электроотрицательными элементами, основную роль играет электростатическое взаимодействие.
Таблица 3.1 — Свойства металлов IIa группы Периодической системы.
| Свойства металлов и их ионов | Be | Mg | Ca | Sr | Ba |
| Атомный номер | |||||
| Атомная масса, г/моль | 9,01 | 24,31 | 40,08 | 87,62 | 132,34 |
| Плотность, г/см3 | 1,84 | 1,74 | 1,55 | 2,63 | 3,63 |
| Температура плавления, °С | |||||
| Температура кипения, °С | |||||
| Энергия ионизации (J1), эВ: | 9,32 | 7,64 | 6,11 | 5,69 | 5,21 |
| Энергия ионизации (J2), эВ: | 18,21 | 15,03 | 11,87 | 10,98 | 9,95 |
| Энергия ионизации (J3), эВ: | |||||
| Работа выхода электрона, эВ | 3,92 | 3,64 | 2,80 | 2,35 | 2,49 |
| Атомный радиуc, нм | 0,113 | 0,160 | 0,197 | 0,215 | 0,221 |
| Ионный радиус (M2+), нм | 0,034 | 0,074 | 0,104 | 0,120 | 0,138 |
| Ионный потенциал, нм-1 | |||||
| Гидратное число иона | – | 13,2 | 12,0 | 10,7 | 7,7 |
| Энтальпия гидратации, кДж/моль | |||||
| Электродный потенциал (расплав), В | –0,90 | –1,59 | — | — | — |
| Электродный потенциал (водн. р–р), В | –1,85 | –2,36 | –2,87 | –2,89 | –2,90 |
| Эффективное сечение захвата тепловых нейтронов, барн (10-28 м2) | 0,009 | 0,059 | 0,43 | — | — |
Хотя свойства бериллия и магния значительно отличаются от свойств других элементов подгруппы, известны некоторые закономерности, свойственные всему ряду Be–Ra:
– усиление основных свойств гидроксидов, увеличение энтальпии их образования и растворимости в воде;
– уменьшение тенденции к гидратации кристаллических солей;
– понижение растворимости в воде сульфатов и галогенидов в этаноле;
– повышение термической устойчивости карбонатов;
– способность образовывать нитриды M3N2 при непосредственном взаимодействии с азотом в условиях повышенных температур.
Атомные радиусы металлов II группы значительно меньше радиусов соседних металлов I группы вследствие увеличения заряда ядра атомов. Поэтому металлы II группы имеют более высокие температуры плавления, кипения и большие плотности. Радиусы атомов в ряду Ве–Ra возрастают, для первых трех элементов группы они существенно отличаются, а далее по группе увеличиваются незначительно, что связано с появлением в электронной структуре атомов заполненных d-подуровней (явление d-сжатия).
Все элементы этой группы имеют низкие электроотрицательности, что подтверждается сильными восстановительными свойствами простых веществ и величинами энергий ионизации. Так как энергии ионизации относительно невелики, то во всех своих соединениях элементы имеют степень окисления(II).
Компактный бериллий окисляется кислородом воздуха только при температуре выше 800°С; при нормальных условиях он покрыт оксидной пленкой. Магний также устойчив из-за тонкой оксидной пленки, но при нагревании до 650°С сгорает. Щелочноземельные металлы (Са, Sr, Ва) на воздухе неустойчивы, легко окисляются, покрываясь рыхлой пленкой, содержащей МО, МО2 и M3N2, которая не предохраняет их от дальнейшего окисления, поэтому их хранят под слоем керосина. Аналогичная зависимость в свойствах элементов наблюдается при их взаимодействии с водой. На бериллий вода не действует. Магний почти не взаимодействует с холодной водой, но медленно выделяет из нее водород при кипячении. Щелочноземельные металлы легко вытесняют водород из воды, причем при переходе от Са к Ra энергичность взаимодействия увеличивается.
Еще одним отличием в свойствах элементов II группы является различная склонность элементов к комплексообразованию. Бериллий образует достаточно прочные комплексы, например, фторидные, ацетилацетонатные, термически устойчивый тетрамин; магний и особенно кальций образуют весьма непрочные комплексы. Так, для магния известен комплекс с ацетилацетоном; для Са аддукты со спиртом и весьма непрочные комплексы с аммиаком; Sr, Ва и Ra комплексов не образуют. Они могут входить в состав комплексного соединения только в виде внешнесферного катиона.
3.2.1 Химия бериллия
Атом бериллия под внешними 2s-электронами имеет оболочку инертного газа гелия с двумя 1s-электронами. Такое строение определяет не только малый объём атома, но слабое экранирование внешних электронов от ядра, а, следовательно, высокую энергию ионизации атома. В результате атомный радиус бериллия (0,113 нм) меньше, по сравнению с атомным радиусом лития (0,155 нм). Энергия ионизации бериллия относительно высока (таблица 3.1), поэтому полной потери обоих электронов с образованием иона Be(II) не происходит. Для бериллия характерны преимущественно ковалентные соединения: связи ВеХ (даже Be–F) в значительной степени носят ковалентный характер.
В случае свободных мономерных молекул ВеА2 (например, газообразна галогенидов при высокой температуре) образуются две эквивалентных sp-гибридные орбитали, получившиеся молекулы линейны, а координациооное число равно 2. Атом бериллия для образования связи имеет четыре энергетически устойчивые орбитали (2s и три 2р), поэтому они не могут образовывать более четырех двухэлектронных связей и в валентном уровне никогда не могут иметь более восьми электронов, поэтому максимальное координационное число у бериллия равно 4. Однако у бериллия имеется всего лишь два электрона, поэтому он имеет сильную тенденцию использовать незанятые орбитали по донорно-акцепторному механизму.
Бериллий обычно достигает координационного числа 4, путем образования двух донорных связей в дополнение к двум простым ковалентным связям. Поэтому те же галогениды при более низкой температуре, а тем более твердом состоянии, полимерны, их координационная сфера — искаженный тетраэдр, вытянутый вдоль оси цепи атомов Be (рисунок 3.1).
U – Hal, – Be
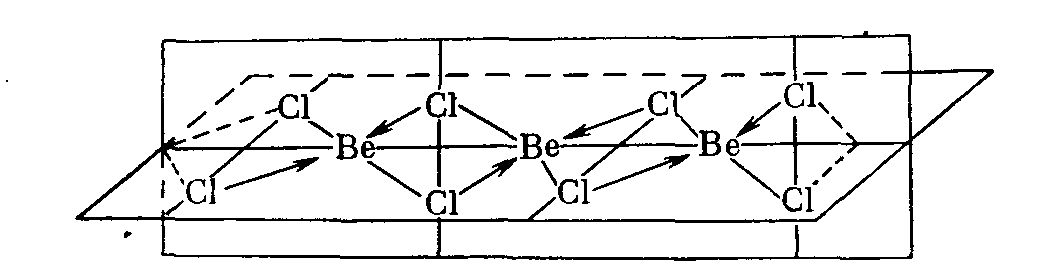
Рисунок 3.1 — Структура полимерных галогенидов бериллия.
Координационное число 4 реализуется в большинстве соединений бериллия. В комплексных соединениях бериллия образуются четыре sр3-гибридные связи в значительной мере полярные, так что комплексы в этом случае носят ионный характер, например ион [BeF4]2- .
Условный ион Ве(II), имея наименьший радиус среди ионов металлов и жёсткую 1s2 электронную оболочку, слабо поляризуется и, напротив, обладает высокой поляризующей способностью. Поэтому, согласно классификации Пирсона ион он относится к типично «жёстким кислотам». Указанные особенности атома и иона бериллия объясняют значительное отличие свойств этого элемента и его соединений от свойств других элементов подгруппы. Кроме того, бериллий обнаруживает большое сходство с цинком — элементом побочной подгруппы, и с алюминием — элементом III группы (диагональное сходство). У бериллия и цинка практически совпадают энергии ионизации (14,93 и 14,94 эВ), а ионы Be(II) и Al(III) имеют близкие значения отношения заряда к радиусу иона (z/r) — 64 и 60, соответственно. В результате у бериллия, цинка и алюминия особенно близки свойства оксидов и гидроксидов, много общего в поведении солей и комплексных соединений.
В водных растворах ионы бериллия гидратируются и гидролизуются, образуя [Ве(Н2O)]42+ и более сложные гидролизованные и полимеризованные частицы.
Сходство в свойствах бериллия и алюминия является наилучшие примером «диагонального сходства». Оксиды и гидроксиды как Be, так и А1 являются амфотерными. Бериллий подобно алюминию растворяется в растворах сильных оснований, образуя тетрагидроксобериллат-ион:
Ве + 2NaOН + 2Н2О → Na2[Ве(ОН)4] + Н2
ВеО напоминает Al2O3 необычно высокой температурой плавления и низкой летучестью, а также чрезвычайной твердостью.
Бериллий — один из наиболее легких металлов и самый легкий из устойчивых на воздухе. Это хрупкий твердый металл светло-серого цвета с металлическим блеском. Природный бериллий состоит из одного стабильного изотопа бериллия Be. Бериллий, имея малую плотность, достаточно тугоплавок, что имеет практическое значение. Бериллий имеет высокие электро- и тепловые характеристики. Электропроводность бериллия в зависимости от способа получения составляет 35–42 % от электропроводности меди; ниже 11 К он обладает сверхпроводимостью. Из всех металлов он имеет самую высокую энтальпию плавления. Его теплоемкость резко возрастает с повышением степени чистоты.
Бериллий отличается особыми ядерно-физическими свойствами, обусловившими его применение в атомной технике. Для него характерна сравнительно небольшая энергия связи нейтронов (1,67 МэВ), что позволяет использовать его в качестве источника нейтронов. Он обладает необычайно малым сечением захвата тепловых нейтронов и высокой способностью их рассеивания (поперечное сечение рассеивания 7,54 барн). Исключительно велика и способность бериллия пропускать рентгеновские лучи (в 16–17 раз больше, чем у алюминия).
По удельной прочности бериллий превосходит все конструкционные металлы и сплавы. Однако механические свойства бериллия в значительной степени связаны со способом его изготовления. В основном они определяются его гексагональной кристаллической решеткой, характеризующейся высокой степенью ориентации. Это приводит к анизотропии механических свойств бериллия, что проявляется в изделиях, полученных обработкой давлением.
Компактный бериллий в обычных условиях устойчив к окислению. Это объясняется тем, что объем оксида бериллия превышает объем металла, из которого он образуется. Поэтому поверхностная оксидная пленка оказывается компактной и защищает металл от дальнейшего окисления. С повышением температуры активность металла повышается, но даже при 500°С окисление ограничивается поверхностным слоем; только выше 800°С идет окисление в массе металла, а при температуре 1200°С он сгорает, образуя оксид бериллия ВеО. Устойчивость бериллия к окислению зависит от метода получения. Порошкообразный бериллий значительно активнее: при нагревании загорается не только в атмосфере кислорода, но и на воздухе.
С водой бериллий практически не взаимодействует, довольно устойчив к действию кислот (если только он не тонко измельчен) вследствие образования на его поверхности инертной и непроницаемой пленки оксида, хотя величина электродного потенциала бериллия (таблица 3.1) должна свидетельствовать о быстрой реакции с разбавленными растворами кислот (и даже с водой). На практике скорость реакции сильно зависит от способа получения металла. В случае очень чистого металла относительные скорости растворения изменяются в следующем порядке:
HF > H2SO4 > НСl > HNO3
Разбавленная азотная кислота в обычных условиях, а также концентрированная при нагревании, взаимодействуя с бериллием, выделяет оксиды азота и аммиак. Концентрированная серная кислота восстанавливается бериллием при нагревании до SO2 и даже до H2S.
Бериллий растворяется не только в кислотах, но и в щелочах, образуя комплексы анионного типа. Взаимодействует с расплавами щелочей и карбонатов, образуя бериллаты:
Ве + Na2СO3 → Na2ВеО2 + CO2
Растворяется он также в водном растворе гидродифторида аммония, что используется для его извлечения из шлака:
Ве + NH4HF2 →(NH4)2ВеF4 + H2
Бериллий восстанавливает до металлов оксиды магния, бария, алюминия и титана; оксид кальция в аналогичных условиях не восстанавливается.
Галогены взаимодействуют с бериллием лишь при нагревании, образуя галогениды ВеХ2. Исключением является фтор, реагирующий с бериллием на холоду.
При нагревании порошкообразного бериллия в атмосфере азота при 500°С образуется нитрид Be3N2. В такой же атмосфере компактный металл образует нитрид только выше 900°С. Бериллий частично взаимодействует с азотом и при нагревании на воздухе. Нитрид образуется также при взаимодействии порошкообразного бериллия с аммиаком (1000°С) и с цианом (800°С).
В расплавленном состоянии бериллий растворяет почти все металлы. Однако до температуры 600°С он устойчив в расплавленных литии, натрии и калии, при более высокой температуре он растворяется в щелочных металлах за счет окисления кислородом, присутствующим в них.
3.2.2 Соединения бериллия
Для технологии и применения важны следующие соединения лития.
Оксид бериллия ВеО получают при прокаливании Ве(ОН)2 или термическом разложении нитрата, оксиацетата, гидроксикарбоната при температуре от 500 до 1000°С в зависимости от исходного соединения. Оксид бериллия, полученный прокаливанием солей или гидроксида представляет собой аморфный порошок. В виде кристаллов может быть получен различными методами, связанными с нагреванием до высокой температуры, в частности при кристаллизации из расплавленных карбонатов щелочных металлов.
Оксид бериллия имеет гексагональную кристаллическую решетку типа цинкита, при 2050°С переходит в тетрагональную модификацию. Оксид бериллия обладает высокой теплопроводностью и незначительным термическим расширением. Сочетание этих свойств делает его превосходным термостойким материалом (таблицf 3.2).
Реакционная способность ВеО зависит от способа получения и особенно от температуры прокаливания. Повышение температуры прокаливания ведет к увеличению размера зерен, т.е. к уменьшению удельной поверхности, а следовательно, и к уменьшению химической активности. По своим химическим свойствам оксид бериллия занимает промежуточное положение между оксидами алюминия и магния. Химическая устойчивость ВеО превосходит химическую устойчивость большинства оксидов металлов.
В воде оксид бериллия почти не растворим. Слабо прокаленный (не выше 500°С) ВеО растворяется в кислотах, даже разбавленных, и в водных растворах щелочей, образуя соответствующие соли и тетрагироксобериллаты. ВеО, прокаленный при 1200–1300°С, еще может растворяться в минеральных кислотах, прокаленный при 1800°С, или после плавления растворим только в плавиковой кислоте. Газообразные галогениды водорода не реагируют с ним даже при сильном нагревании. Растворяется в расплавленных щелочах, карбонатах и пиросульфатах щелочных металлов. Оксид бериллия взаимодействует с гексафторсиликатом Na2SiF6 и гексафторферратом натрия Na2FeF6, что используется при регенерации урана и бериллия из отходов производства или облученного ядерного топлива.
Оксид бериллия при нагревании взаимодействует с целым рядом хлористых соединений (хлором в присутствии углерода, фосгеном, тет-рахлоридом углерода и др.). Например, реакция с фосгеном начинаете» при 500°С
BeO + COCl2 → BeCl2 + CO2
В связи с большим сродством бериллия к кислороду ВеО восстанавливается далеко не всеми обычно применяемыми восстановителями. Кальций может быть использован в качестве восстановителя при температуре ниже 1700°С и атмосферном давлении.
Давление пара ВеО незначительно. В отсутствие паров воды это наименее летучий из тугоплавких оксидов. В присутствии паров воды при 1000–1800°С летучесть сильно возрастает в связи с образованием газообразного гидроксида.
Таблица 3.2 — Свойства некоторых соединений бериллия.
| Свойства металлов и их ионов | BeО | Be(ОH)2 | BeF2 |
| Плотность, г/см3 | 3,02 | 1,92 (α) | — |
| Температура плавления, °С | ~2550 | — | |
| Температура кипения, °С | ~4000 | — | |
| Давление пара (2000°С), Па | 0,00084 | — | — |
| Энтальпия образования, кДж/моль | -599,6 | — | -1009 |
| Растворимость в воде (25°C), г/л (мг/л) | (0,05–0,2) | (2) |
Гидроксид бериллия Ве(ОН)2 — типично амфотерное соединение, мало растворимое в воде (2 мг/л при 25°С). Известен в виде трех модификаций: аморфной, метастабильной α-формы и кристаллической β-формы. Аморфный гидроксид Ве(ОН)2·xН2О получается действием растворов щелочей и аммиака на растворы солей бериллия.. Осаждение гидроксида бериллия из растворов солей, за исключением фторидов, происходит при рН ~6, что близко к условиям выделения гидроксида алюминия. Поэтому разделение алюминия и бериллия дробным осаждением их гидроксидов неэффективно. Из растворов фторида бериллия и особенно фторобериллатов гидроксид бериллия осаждается при рН 11, что позволяет из таких растворов отделять Be от Fe и А1 дробным осаждением их гидроксидов.
Свежеосажденный аморфный гидроксид хорошо растворим в кислотах и щелочах. В отличие от гидроксидов алюминия и железа растворяется в растворах карбоната аммония и гидрокарбонатов щелочных металлов, а также в растворах ряда солей бериллия (фторида, сульфата), образуя комплексные соединения. При поглощении из воздуха CO2 образуется гидроксокарбонат Ве4(ОН)6СО3. Благодаря большой удельной поверхности аморфный гидроксид может сорбировать из растворов различные примеси, в том числе соли аммония и щелочных металлов.
Аморфный гидроксид бериллия с трудом обезвоживается. При 100°С даже после 2 ч высушивания удаляется не более 50 % влаги. Лишь повышение температуры до 180°С позволяет получить безводный Ве(ОН)2. Кристаллическая β-форма начинает разлагаться до оксида выше 200°С, но получить безводный оксид удается лишь прокаливанием при 800–900°С.
α-Ве(ОН)2 образуется в результате старения аморфного гидроксида при хранении на воздухе и в воде. Он менее активен, на холоду медленно растворяется в щелочах и кислотах, при нагревании растворимость улучшается. Не сорбирует примеси и не поглощает диоксид углерода и аммиак.
β-Ве(ОН)2 выделяется из растворов бериллатов при кипячении и введении затравки гидроксида.
Состояние бериллия в водных растворах. В концентрированных кислых растворах бериллий, по-видимому, существует в виде тетрааква ионов [Ве(Н2O)4]2+, и эти ионы встречаются в некоторых солях. Вода в таких солях связана довольно прочно. Растворы всех бериллиевых солей имеют кислую реакцию вследствие гидролиза. Они могут растворять значительные количества оксида или гидроксида бериллия из-за образования бериллием оксо- и гидро-ксокомплексов с Be—О—Be и Be—ОН—Be мостиками.
При осаждении Be(ОН)2 растворы остаются прозрачными, если число ионов ОН– (n), добавленных в расчете на один ион Ве2+, меньше 1. Осаждение начинается при n > 1. В случае солей галогеноводородных кислот полное осаждение достигается при n = 2, а с остальными ионами полное осаждение осуществляется при n = 1,8–1,9, что свидетельствует о том, что осадок гидроксида бериллия содержит анионы соли, из которой ведется осаждение (сульфат, нитрат, перхлорат).
Тот факт, что осаждение происходит только тогда, когда n > 1, позволяет утверждать, что существуют растворимые частицы [Ве(ОН)]nn+. Наличие таких частиц с n = 3 было подтверждено потенциометрическим титрованием разбавленных растворов. Структурная формула [Ве(ОН)]33+.показана на рисунке 3.3.
В разбавленных щелочных растворах гидроксида бериллия образуется полиатомный ион типа [Веn(ОН)2n+m]m-. С повышением концентрации щелочи он постепенно превращается в мономерный тетрагидроксобериллат-ион [Ве(ОН)4]2-, который затем, отщепляет воды и дает ион ВеО2-. Практически полное превращение наступает при соотношении Na2О:ВеО = 8:1. Тетрагидроксобериллат значительно устойчивее полиатомного, поэтому при высокой концентрации щелочи даже кипячение не приводит к выделению гидроксида бериллия в осадок.
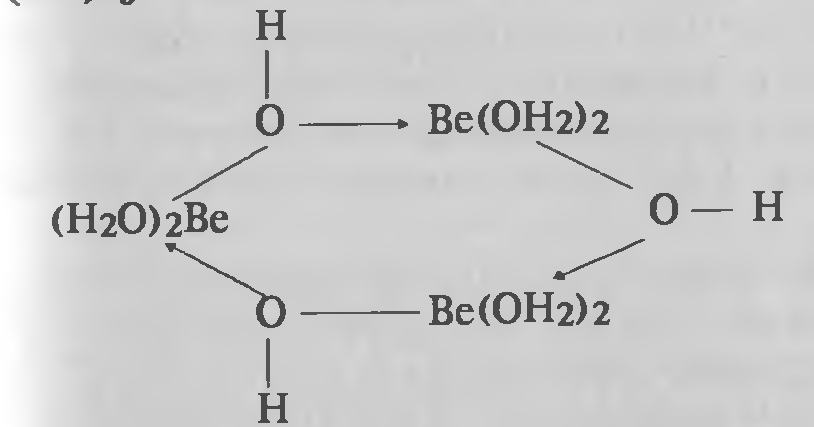
Рисунок 3.3 — Строение полимерных ионов[Ве(ОН)]33+.
Сульфат бериллия BeSO4·Н2O — четырехводный гидрат, устойчивый на воздухе. Выделяется из растворов, полученных обработкой оксида или гидроксида бериллия разбавленной серной кислотой, после их упаривания и охлаждения. Кристаллы сульфата псевдокубические, плотность их 1,713 г/см3.
Безводный сульфат бериллия получают термическим обезвоживанием четырехводного гидрата при 400°С. Процесс протекает путем образования ряда промежуточных гидратов при 115, 200 и 250°С. Сульфат бериллия устойчив до температуры 550°С, при которой он начинает разлагаться, выделяя SO3. Полное разложение наступает при 1031°С. Метод термической диссоциации сульфата используют в промышленности для получения оксида бериллия..
Растворимость сульфата бериллия в воде при 25°С ~424 г/л, при 100°С ~1 кг/л. На уменьшении растворимости с понижением температуры основана его очистка перекристаллизацией. Серная кислота «высаливает» сульфат бериллия из растворов, при концентрации серной кислоты 66 % растворимость сульфата уменьшается приблизительно до 9 г/л. С повышением концентрации серной кислоты уменьшается и содержание воды в осадке. BeSO4 в отличие от сульфатов алюминия и магния растворяется в присутствии сульфата аммония (рисунок 3.4).
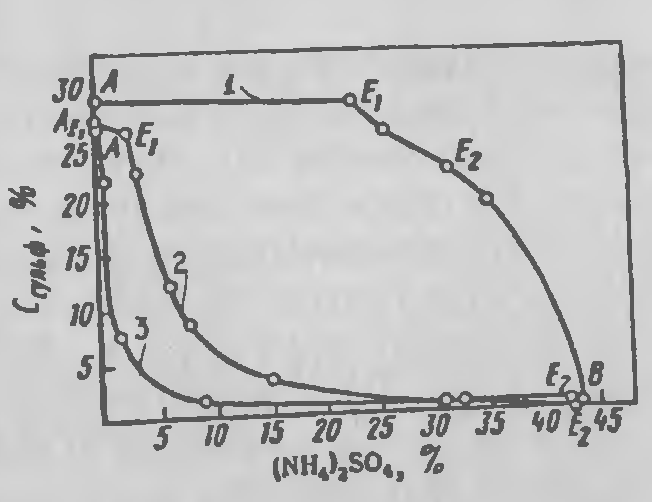
Рисунок 3.4 — Кривые растворимости сульфатов 1– Be; 2– Mg; 3– Al в присутствии сульфата аммония.
Карбонат бериллия. Известны карбонат ВеСО3·4Н2O и гидроксокарбонаты различного состава. Плохо растворимый Ве(ОН)2СО3 образуется при взаимодействии водных растворов карбонатов щелочных металлов или карбоната аммония с солями бериллия. Из кипящих растворов выделяются в виде плотного осадка гидратированные гидроксокарбонаты переменного состава: Ве(n+1)(ОН)2nСО3·mH2O, где n = 2, 3, 4, 5, 7; m = 1, 2, 3.
В избытке карбонатов щелочных металлов и карбоната аммония гидроксо-карбонаты и гидроксид бериллия образуют растворимые комплексные соединения:
Be(ОН)2 + 2(NH4)2СО3 → (NH4)2[Be(СО3)2] + 2NH4OH.
Карбонат бериллия образуется из тех же растворов, что и гидроксокарбонат, но в присутствии большого избытка СО2.. Чтобы выделить карбонат, раствор упаривают в атмосфере СО2. Несколько выше 100°С карбонат начинает разлагаться, выделяя СО2.
Галогениды бериллия
Свойства фторида бериллия отличаются от свойств остальных его галогенидов. Это различие определяется разным характером связи бериллий – галоген. Связь Be–F на 80 % носит ионный характер, связи Be с другими галогенами по преимуществу ковалентные. Ионные составляющие связей Be–Cl, Be–Br и Be–I соответственно достигают только 42; 35 и 25 %. Этим объясняется устойчивость чисто фторидных комплексов бериллия и способность хлоридов, бромидов и иодидов (но не фторидов) образовывать стабильные комплексы с нейтральными лигандами.
Фторид бериллия BeF2 — бесцветное гигроскопичное вещество. Расплавленный, он при застывании образует стекловидную массу. Это объясняется тем, что по структуре BeF2 аналогичен SiO2. Может быть получен упариванием раствора Ве(ОН)2 в плавиковой кислоте и дальнейшим высушиванием в токе HF. В промышленности пользуются термическим разложением тетрафторобериллата аммония. Разложение (NH4)2BeF4 с достаточной скоростью протекает при 400°С, но получающийся продукт — тонкий порошок, легко гидролизуется. Поэтому практически применяют высокотемпературное разложение (900°С).
Фторид бериллия — одно из самых устойчивых его соединений (таблица 3.2), вследствие чего не все применяемые на практике восстановители восстанавливают его до металла, в частности BeF2 нельзя восстановить водородом.
Фторид бериллия хорошо растворим в воде (таблица 3.2), частично при этом гидролизуясь. В растворе фторид бериллия находится главным образом в виде комплекса. Это подтверждается низкой электропроводностью раствора BeF2.
Если упарить раствор и сухой остаток прокалить, то образуется оксифторид бериллия Be7O2F10 — пушистый белый порошок. В расплавленном состоянии фторид и оксифторид бериллия ничтожно электропроводны. Подобно фториду бериллия оксифторид хорошо растворяется в воде.
BeF2 не растворяется в плавиковой кислоте, но со фторидами щелочных металлов и аммония образует растворимые в воде комплексные фторобериллаты.. В зависимости от соотношения F:Be и значения рН в водных растворах могут присутствовать различные фторобериллатные комплексные ионы: BeF+, BeF3- и BeF42-. Эти ионы гидратированы, например ион BeF+ имеет строение [BeF(H2О)3]+. Комплексообразование усиливается в избытке фторид ионов. Образующиеся в растворах комплексные анионы дают с катионами соответствующие соли.
На использовании фторобериллатов основаны вскрытие бериллиевых руд фторидными методами и металлотермическое получение бериллия. В связи с этим несомненный интерес представляют данные о плавкости в системе BeF2—MgF2 (рисунок 3.5). В расплавленном состоянии они неограниченно взаимно растворимы, не образуют ни соединений, ни твердых растворов, что позволяет получить чистый металлический бериллий.
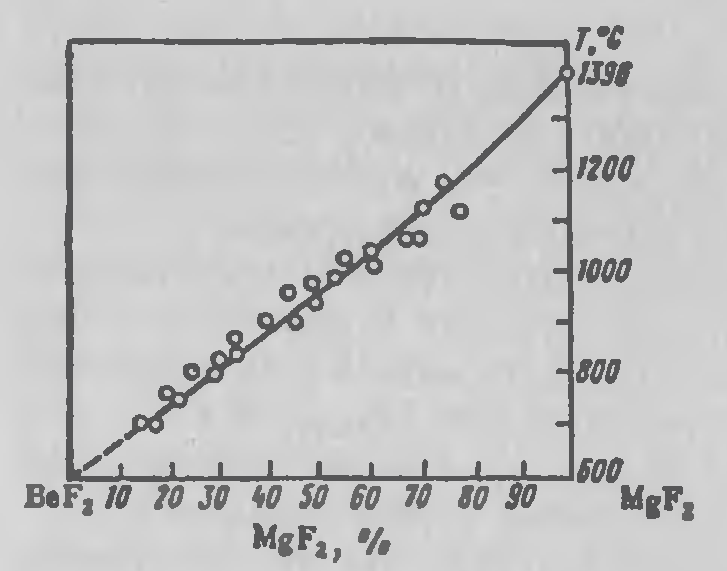
Рисунок 3.5 — Диаграмма плавкости в системе BeF2—MgF2.
Хлорид бериллия — белые или слегка зеленоватые игольчатые кристаллы, расплывающиеся на воздухе из-за сильной гигроскопичности; плотность 1,9 г/см3. ВеCl2 можно получить хлорированием ВеО различными хлорирующими агентами. Наиболее часто используется реакция между оксидом бериллия и хлором в присутствии угля, идущая при 800°С. При 500 и 450°С идет хлорирование соответственно фосгеном и тетрахлоридом углерода. Температура плавления ВеCl2 415°С, температура кипения 550 °С. Но уже при 400°С начинается сублимация с образованием волокнистых кристаллов полимерной структуры, относящейся к ромбической сингонии. Повышение температуры ведет к диссоциации. Летучесть хлорида бериллия ниже, чем хлоридов алюминия железа и кремния (рисунок 3.6). Это используется для отделения бериллия от указанных элементов при хлорировании берилла.
Хлорид бериллия — менее прочное соединение, чем его фторид, но и он не восстанавливается водородом. Как и фторид, восстановить его можно такими металлами, как натрий, магний, кальций.
В воде ВеCl2 легко растворяется, выделяя значительное количество тепла; склонен к гидролизу. Степень гидролиза зависит от рН раствора. Присутствие соляной кислоты подавляет гидролиз. В концентрированных солянокислых растворах образует с НС1 катионные комплексы, например [ВеCl]+, но тем не менее бериллий мало склонен к образованию хлоридных комплексов. Подтверждением этому служит хорошая электропроводность растворов ВеCl2 (в отличие от растворов фторида бериллия).
Из водных растворов хлорид бериллия выделяется в виде устойчивого гидрата ВеCl2·4Н2О. При нагревании тетрагидрата удаляется часть соляной кислоты и образуются труднорастворимые в воде гидроксосоли переменного состава. Гидроксосоли выделяются также при упаривании водных растворов хлорида бериллия.
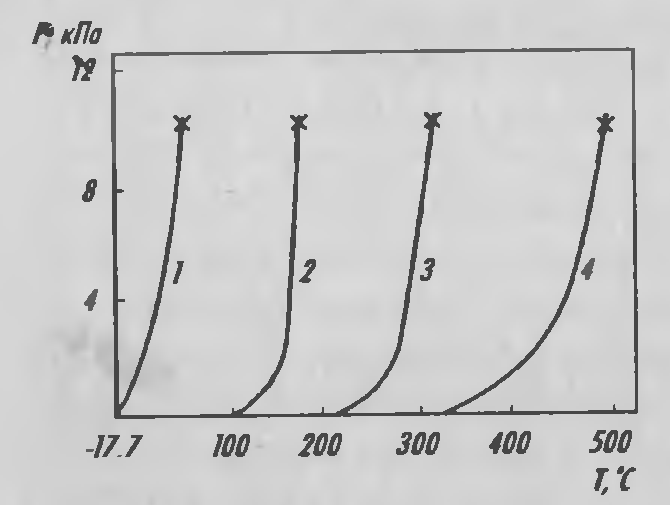
Рисунок 3.6 — Зависимость давления паров хлоридов 1– Si; 2– Al; 3– Fe; 4– Be от температуры (x– точки кипения).
Дата добавления: 2015-06-22; просмотров: 15369;
