ВОССТАНОВЛЕНИЕ МАРГАНЦА
Марганец растворяется в железе в любых соотношениях. Имея значительное сходство с железом по атомной массе и другим свойствам, марганец образует с железом раствор, близкий к идеальному. В чистых сплавах Fe-Mn активность марганца изменяется почти полностью в соответствии с законом Рауля. На практике обычно имеется раствор Fe-C-Mn. Углерод уменьшает активность марганца (рис. 11.6), что может быть связано с образованием карбида марганца Мп3С, и наблюдается отрицательное отклонение от закона Рауля.
11.4.1. Влияние температуры.Марганец — элемент, легко окисляющийся, особенно при сравнительно низких температурах; при этом могут образовываться следующие его оксиды: МпО2, Мп2О3, Мп3О4, МпО.
При высоких температурах устойчивым является только МпО. Окисление марганца может происходить как в результате взаимодействия с кислородом, растворенным в металле,
[Мп] + [О] = (МпО)1,
ΔGo= -244 000 +108,78 Т,
так и при непосредственном взаимодействии с кислородом газовой фазы
[Mn] + l/202(r) = (MnO),
ΔGo=-361000 + 106,39T
или с оксидами железа шлака
[Мп] + (Fe)= (МпО) + Fеж
ΔGo= -123000 + 56,40Г.
На основании данных об изменении энергии Гиббса можно сделать следующие выводы: 1) при окислении марганца выделяется тепло; 2) при повышении температуры возможно восстановление марганца из шлака.
Из шлака марганец при благоприятных условиях может восстанавли ваться железом,
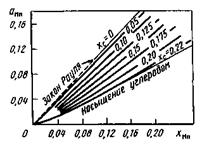
Рис. 11.6.Изменение активности марганца
аМп по мере повышения в стали содержания
углерода (цифры у кривых)
углеродом, кремнием. Константа равновесия реакции (FeO) + [Мп] = (МпО) + Реж, равная
КMn = a(MnO)/a(FeO)*a(MnO), с повышением температуры уменьшается, т. е. равновесие реакции сдвигается в сторону восстановления марганца. Поскольку раствор марганца в железе близок к идеальному, константа равновесия имеет вид:
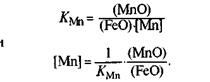
Даже небольшие колебания температуры могут сказаться на изменении содержания марганца.
11.4.2. Влияние состава шлака.Из уравнения для КMn следует, что
[Мn] = (1/KМn) * (a(MnO)/a(FeO) ).
Это означает, что при данной температуре содержание марганца в металле определяется соотношением активностей МпО и FeO в шлаке. Поскольку МпО— основный оксид и в кислых шлаках a(MnO) уменьшается в связи с образованием силикатов марганца, под кислыми шлаками (рис. 11.7) процесс окисления марганца идет более полно (например, в бессемеровском конвертере марганец окисляется практически до следов). При работе под основными шлаками, содержащими МпО, концентрация марганца в металле определяется температурой и a(Fe0)- Введение в ванну большой порции железной руды вызовет повышение a(FeO), содержание марганца в металле при этом уменьшится. Интенсивное протекание реакции (FeO) + [С] = СО + Fеж вызывает некоторое уменьшение a(FeO), что приводит к увеличению содержания марганца в металле.
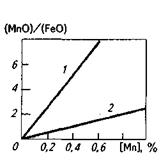
Рис. 11.7.Зависимость отношения (МпО)/(FеО) в кислом (7) и основном (2) шлаках от содержания марганца в металле
Окисленность шлака уменьшается при введении в ванну сильных раскислителей. При этом возрастает содержание [Мп]. В некоторых случаях для повышения a(MnO) в шлак добавляют марганцевую руду или другие материалы, содержащие оксиды марганца. Если ввести в ванну некоторое количество марганца (обычно в виде сплава с железом — ферромарганца), то часть его окислится до содержания, соответствующего соотношению
КMn = a(MnO)/a(FeO) * [Мn],
а часть останется в металле.
Дата добавления: 2015-06-22; просмотров: 836;
