КИСЛЕНИЕ УГЛЕРОДА
Реакцию окисления углерода часто называют основной реакцией сталеплавильных процессов. При окислении (выгорании) углерода происходит так называемое кипение металла в результате выделения пузырей СО. В процессе кипения происходят перемешивание металла, выравнивание его химического состава и температуры, увеличивается площадь соприкосновения металла со шлаком, что, в свою очередь, ускоряет протекание всех процессов на границе шлак—металл, из металла удаляются газы и неметаллические включения. В большинстве случаев в сталеплавильных агрегатах подачу энергии к ванне (топливными горелками, электрической дугой и т. п.) осуществляют сверху и, если бы не кипение, нагрев глубинных слоев ванны был бы весьма затруднен. Углерод, растворенный в железе, принято обозначать [С].
|11.2.1.Продукты реакции.Углерод, растворенный в металле, окисляется в основном до СО. Однако при низких концентрациях углерода кроме реакции [С] + [О] = СОГ имеет место реакция [С] + 2[О] = СО2(Г). По расчетным данным, если при 0,2 % [С] в железе удельный вес реакции образования СО2 составляет всего 0,5%, то при 0,03 % [С] — 10 %. В большинстве случаев можно с достаточной для практических целей точностью считать, что углерод окисляется с образованием СО. Константа равновесия этой реакции Кс может быть выражена формулой
Кс = рСО/(а[С] * а[0]) =
= Pco/([C]*f[C]* [0]*f[0]).
Значения коэффициента активности f[с] и f [О] до настоящего времени точно не определены. Но поскольку на практике обычно имеют дело с расплавами, содержащими малое (< 1 %) • количество углерода и очень малое (<0,1 %) количество кислорода, можно принимать значения/[с] и/[О] близкими к единице. Следовательно, Кс= рСО /([С]*[О]). При рСО =1 Кс =
= 1/([С] • [О]), или [С] • [О] = 1/Кс = т.
Произведение [С] • [О] при нормальном атмосферном давлении принимают обычно близким к значениям, определенным впервые Вачером и Гамильтоном (США) для 1620 ºС: т =[С] • [О] =0,0025. Полученные на практике значения [С] и [О] сравнивают обычно со значениями, определяемыми из равенства [С] -[О] = 0,0025.
11.2.2. Соотношение между содержаниями углерода и кислорода.На основании опытных данных установлено, что при протекании реакции обезуглероживания содержание кислорода в ванне определяется прежде всего концентрацией растворенного в металле углерода. На содержание [О] определенное влияние оказывают также активность оксидов железа в шлаке, температура металла, содержание в металле разных примесей и т. д. Однако в момент интенсивного кипения ванны протекает реакция [О] + [С] = СОГ и окисленность металла определяется содержанием углерода.
На практике окисленность металла [О]Пр при данном содержании углерода обычно несколько выше равновесной концентрации кислорода [О]р. Разность [О]пр-[О]р = Δ[О] обычно невелика, однако в некоторые моменты плавки величина Δ [О] может стать значительной. В период интенсивной продувки сталеплавильной ванны кислородом могут создаваться условия, когда интенсивность подачи кислорода превышает интенсивность его расходования на окисление углерода, при этом значение Δ [О] заметно возрастает. Данное явление иногда называют аккумуляцией ванной кислорода.
Через несколько минут после прекращения продувки (продолжительность которой зависит от содержания углерода и других факторов) величина Δ [О] уменьшается до обычных значений.
Увеличение Δ [О] возможно также в том случае, когда в ванну для интенсификации процесса обезуглероживания введено очень много железной руды. В результате температура ванны снижается настолько, что не обеспечивается необходимый для процесса минимальный перегрев металла над линией ликвидуса. В этом случае имеют место повышенные концентрации оксидов железа в шлаке. Поскольку кислород из атмосферы продолжает переходить через шлак в металл, а расходования кислорода на окисление углерода не происходит, величина Δ [О] растет.
Последующие повышение температуры металла и достижение необходимого уровня его перегрева обеспечат возобновление реакции [О] + [С] = = СОГ, и величина Δ [О] уменьшится до обычных значений.
Температура ликвидуса зависит от состава стали. Для .расплава нелегированных сталей можно пользоваться формулой tЛИКВ= 1530-71 [С]. Перегрев металла над линией ликвидуса, обеспечивающий нормальное кипение, составляет 40—100 °С. Перегрев менее 40 °С можно считать низким, более 100 °С —высоким.
11.2.3. Кинетика процесса.Процесс обезуглероживания складывается, по крайней мере, из трех звеньев:
а) подвод к месту реакции реагентов — углерода и кислорода;
б) реакция между [С] и [О];
в) выделение продуктов реакции б) — пузырей СО или смеси (СО + СО2) в газовую фазу.
Кажущаяся энергия активации Е реакции [С] + [О] = СО сравнительно невелика и, по разным данным, составляет Е- 80-120 кДж/моль, что свидетельствует о том, что реакция протекает практически мгновенно. Растворимость СО в жидкой стали ничтожно мала, поэтому можно считать, что реакция окисления углерода протекает гетерогенно, т. е. растворенные в железе атомы углерода и кислорода только на границе металла с газовой фазой образуют молекулу СО, переходящую в газовую фазу. Соответственно лимитирующими звеньями процесса в целом являются а) и в).
11.2.4. Критические концентрации углерода.Характер кинетических кривых окисления углерода при разных его концентрациях неодинаков. По достижении определенной, так называемой критической концентрации углерода (0,15-0,35%) отмечено заметное снижение скорости его окисления (рис. 11.2). В данном случае под критической концентрацией понимают концентрацию (или область концентраций), при которой изменяется режим взаимодействия. Как установлено, в области концентраций углерода выше критических зависимость содержания углерода в металле от времени т характеризуется прямой линией, что свидетельствует о том, что процесс лимитируется внешней диффузией (интенсивностью подачи кислорода). Подобное состояние продолжается до так называемой 1-й критической концентрации.
Практически это означает, что если мы хотим ускорить процесс обезуглероживания (при содержании углерода выше критического), то достаточно более интенсивно подавать в металл
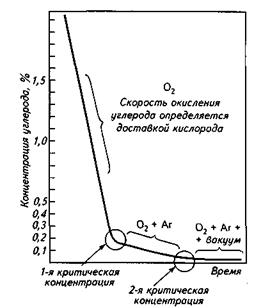
Рис. 11.2. Кинетика реакции обезуглероживания
кислород, т. е. область на кинетической кривой реакции окисления углерода до 1-й критической концентрации есть область «кислородного голода» (рис. 11.2).
Ниже 1-й критической концентрации ситуация меняется: на скорость процесса начинает влиять еще один фактор — массоперенос углерода к месту реакции («углеродный голод»). Если требуется ускорить процесс в этой области, то необходимо кроме интенсивной подачи кислорода организовать интенсивное перемешивание. Обычно это осуществляется продувкой металла аргоном снизу. Если искусственного перемешивания не проводить, то реакция окисления углерода будет идти медленно, окисляться будет не только углерод, но и железо, и при этом будет увеличиваться окисленность как металла, так и в значительной степени шлака.
В случае, если нам требуется обеспечить снижение содержания углерода до весьма низких пределов (менее 0,05—0,03 %), подачи кислорода и искусственного перемешивания уже недостаточно — необходимо обеспечить интенсивный отвод продукта реакции
(СО). Это достигается вакуумной обработкой металла. На практике получение низкоуглеродистых марок стали обеспечивается при продувке металла только кислородом сверху или кислородом сверху при перемешивании аргоном снизу (во втором случае угар металла и окисленность ванны меньше). Получение же особонизкоуглеро-дистых марок стали (ниже 2-й критической концентрации) обеспечивается одновременным воздействием струй кислорода, перемешиванием инертным газом (увеличивается величина поверхности контакта металл—окислитель и облегчаются условия зарождения пузырей СО) и обработкой вакуумом (интенсивный отвод продукта реакции — СО — из зоны реагирования).
Если принять, что скорость реакции обезуглероживания
d[C]/d 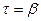 (S/V) W,
(S/V) W,
где S— поверхность контакта реагирующих фаз; V— объем ванны металла; W— интенсивность подачи окислителя; 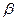 — обобщенный коэффициент массопереноса, то
— обобщенный коэффициент массопереноса, то 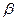 1>
1> 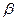 2»
2» 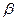 з, где
з, где 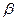 1,
1, 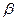 2,
2, 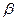 з — коэффициенты массопереноса на разных участках кинетической кривой (рис. 11.2),
з — коэффициенты массопереноса на разных участках кинетической кривой (рис. 11.2),
то скорость процесса обезуглероживания может лимитироваться также и третьим звеном в) — выделением СО (см. п. 11.2.3). Для того чтобы в металле мог образоваться пузырь СО, он должен преодолеть давление столба металла pм, шлака рш и атмосферы pатм над ним, а также силы сцепления жидкости 2с/г, т. е.
Рсовыд 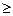 Рм+Рш+ Ратм + 2
Рм+Рш+ Ратм + 2 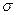 /r,
/r,
где г—радиус пузыря СО. Значение 2 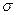 /r становится практически значимым при малых радиусах пузырей; при г>1мм значением 2
/r становится практически значимым при малых радиусах пузырей; при г>1мм значением 2  /rможно пренебречь.
/rможно пренебречь.
Образование пузырей внутри объема жидкого металла практически невозможно. Оно возможно лишь на границе раздела фаз. Такими границами могут быть границы раздела: шлак—металл, неметаллическое включение—металл, газовый пузырь—металл, футеровка—металл. Учитывая шероховатость и плохую смачиваемость металлом огнеупорной футеровки, можно считать, что условия образования пузырей СО на границе металл—огнеупорная футеровка наиболее благоприятны. При продувке металла в подовой печи или в конвертере кислородом или воздухом зонами преимущественного протекания данной реакции становятся также газообразные полости внутри металла с сильноразвитой поверхностью раздела жидкой и газообразной фаз.
Величина ∑p =p атм + рш + рм в зависимости от глубины ванны (высоты столба металла) и места отбора проб (под шлаком или у подины) для разных агрегатов может колебаться в пределах от 106 до 160 кПа. Соответственно изменяются и значения равновесных концентраций растворенного в металле кислорода, так как изменения давления влияют на соотношение равновесных концентраций [С] и [О] (рис. 11.3). Если иметь в виду, что Кс=Рсо/[С] • [О], то на поверхности ванны при нормальном атмосферном давлении Кс= 1/[С] • [О]. На глубине с учетом давления столба шлака и металла общее давление в месте выделения пузырей СО может быть выше, например, в 1,5 раза. При этом КС=1,5/[С] • [О] и [О] = 1,5/ КС • [С], т. е. равновесная в данных условиях концентрация кислорода выше в 1,5 раза.
11.2.5. Влияние температурына процесс обезуглероживания термодинамически оценивается следующим образом:
а) при окислении углерода, растворенного в металле, растворенным в металле кислородом
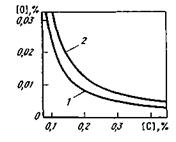
Рис. 11.3.Соотношение между содержанием углерода и кислорода в металле:
/ — [С] • [О] =0,0025 на поверхности ванны при /)со=100кПа; 2 —то же, на глубине ванны при
Рсо= 150кПа
[С] + [О] = СОГ,
ΔG0 = -25000-37,90Т;
б) при окислении кислородом оксидов железа шлака
[С] + (FeO) = Feж + СОГ,
ΔG0 = + 115000-98,18Т;
в) при окислении непосредственно кислородом
[С] + 1/2О2(г)=СОг,
ΔG0 = -142 000 -40,79 Т.
Таким образом, во всех случаях изменение энергии Гиббса ΔG0 с повышением температуры уменьшается, т. е. создаются более благоприятные условия для протекания реакции окисления углерода. Принимая во внимание, что повышение температуры всегда приводит к увеличению скоростей реакций, а также что реакция окисления углерода практически необратима, так как образующийся монооксид углерода непрерывно покидает реакционную зону и процесс идет только в сторону уменьшения содержания углерода, можно считать, что повышение температуры всегда способствует ускорению реакции окисления углерода.
Минимальный перегрев металла над линией ликвидуса, при котором начинается процесс окисления углерода, составляет 30—40 °С. При окислении углерода газообразным кислородом выделяется большое количество тепла, а при окислении углерода оксидами железа шлака тепло поглощается. Иногда в ванну для ускорения обезуглероживания загружают чрезмерно большое количество таких окислителей, как железная руда, окалина и т. п. Температура ванны при этом снижается, так как, во-первых, тепло расходуется на нагрев самих добавок, во-вторых, начавшаяся реакция [С] + (FeO) требует затрат тепла. В результате наступает момент, когда перегрев металла над линией ликвидуса становится ниже минимально необходимого перегрева (для зарождения пузырей СО) и кипение ванны прекращается (или резко замедляется). При отсутствии кипения окисленность металла регулируется не углеродом, а активностью оксидов железа в шлаке, поэтому содержание кислорода в ванне в таких случаях резко возрастает. В тот момент, когда температура ванны при ее прогреве повысится до значений, при которых условия зарождения пузырей СО вновь станут благоприятными, в ванне может оказаться чрезмерно большое количество кислорода и реакции [С] + [О] и [С] + (FeO) могут приобрести взрывной характер (в короткий момент времени выделится очень большое количество СО), сопровождаться выбросами из печи или из конвертера жидкого металла и шлака.
11.2.6. Влияние футеровки.Выше уже отмечалось, что на границе металл—футеровка создаются благоприятные условия для зарождения пузырей СО. Любая футеровка представляет собой материал с большим или меньшим количеством крупных и мелких пор. Силы поверхностного натяжения препятствуют заполнению этих пор металлом (рис. 11.4); в результате между поверхностями пор огнеупорной футеровки и поверхностью металла всегда есть полости, заполненные газом, а на поверхности металла — повышенные концентрации поверхностно-активных веществ. Готовые (уже зародившиеся) газовые полости-пузыри в порах огнеупорной футеровки обеспечивают возможность протекания реакции окисления углерода на границе футеровка-металл. Если после выпуска плавки проанализировать тот слой футеровки, который соприкасался с металлом, то окажется, что в нем содержится значительное количество оксидов железа. Согласно опытным данным поверхностные слои подины мартеновской печи после выпуска плавки содержат 15-23 % FeO и 1,5-3,0 % Fe2O3, а через несколько минут — уже 27-35 % FeO и 7-9 % Fe2O3. В результате воздействия окислительной атмосферы печи небольшие количества металла и шлака, оставшиеся после предыдущей плавки, окислялись и образующиеся оксиды насыщали поверхностные слои подины. Во время плавления и кипения металла происходит восстановление этих оксидов железа углеродом, и перед раскислением подина содержит: для высокоуглеродистых сталей 16-21 % FeO и 2-4 % Fe2O3, для низкоуглеродистых 18-26 % FeO и 2-4 % Fe203. При восстановлении оксидов железа углеродом в результате образования монооксида углерода в поверхностных слоях образуются поры (до 1—2 мм), что является дополнительным стимулятором кипения металла на границе металл—огнеупорная футеровка пода печи.
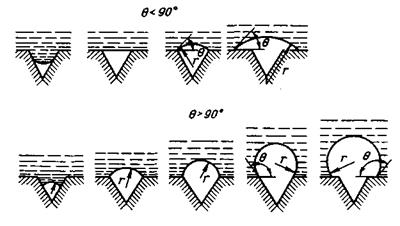
Рис. 11.4.Схема образования пузырей на границе раздела фаз жидкость—твердое тело в зависимости от величины угла смачивания Ө
11.2.7. Влияние снижения давления (обработки вакуумом).Из значения константы равновесия реакции [С] + [О] = СОГ получаем а[С] ] • а[О] = Рсо/К. При уменьшении давления раскислительная способность углерода возрастает и окисленность металла снижается. Действительно, при обработке жидкой стали вакуумом в отсасываемых газах содержится СО, а окисленность металла снижается, однако наблюдаемое при этом снижение содержания кислорода непропорционально снижению давления. Это кажущееся несоответствие можно объяснить следующим образом: при отсутствии шлака в вакуумной камере давление выделения СО соответствует выражению
Рсо  Ратм + Рм + 2σ/г. Влияние вакуума на раскислительную способность углерода определяется соотношением между ратм (степенью разрежения) и рм + 2σ/г . Если рм + 2 σ/г
Ратм + Рм + 2σ/г. Влияние вакуума на раскислительную способность углерода определяется соотношением между ратм (степенью разрежения) и рм + 2σ/г . Если рм + 2 σ/г 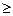 Ратм, то дальнейшее понижение давления практически уже не может изменить значение рсо и поэтому не может влиять на повышение раскислительной способности углерода в жидком железе. Помимо углерода и кислорода сталь всегда содержит определенное количество других примесей, в том числе газов — водорода и азота. При обработке вакуумом газы, растворенные в металле, выделяются, образующиеся пузыри перемешивают массу металла и этот процесс влияет на обезуглероживание. В свою очередь, выделение пузырей СО влияет на изменение содержания водорода и азота. На практике при обработке больших масс металла для снижения содержания кислорода, водорода и азота стремятся иметь в вакуумной камере давление 130— 260 Па. Поскольку кислород при этом удаляется в результате взаимодействия с углеродом, содержание углерода также снижается.
Ратм, то дальнейшее понижение давления практически уже не может изменить значение рсо и поэтому не может влиять на повышение раскислительной способности углерода в жидком железе. Помимо углерода и кислорода сталь всегда содержит определенное количество других примесей, в том числе газов — водорода и азота. При обработке вакуумом газы, растворенные в металле, выделяются, образующиеся пузыри перемешивают массу металла и этот процесс влияет на обезуглероживание. В свою очередь, выделение пузырей СО влияет на изменение содержания водорода и азота. На практике при обработке больших масс металла для снижения содержания кислорода, водорода и азота стремятся иметь в вакуумной камере давление 130— 260 Па. Поскольку кислород при этом удаляется в результате взаимодействия с углеродом, содержание углерода также снижается.
Метод обработки вакуумом для снижения содержания в металле углерода используют в тех случаях, когда другие, более простые способы не приводят к должному результату (например, при необходимости получения металла с очень низким содержанием углерода, когда обычная продувка металла кислородом сопряжена с большими потерями железа вследствие его окисления).
11.2.8. Влияние продувки металла инертным газом.При продувке жидкой стали чистым кислородом образующаяся газовая фаза (в виде массы выделяющихся из ванны пузырей) практически состоит из СО. При продувке не чистым кислородом, а смесью кислорода с инертным газом (например, О2 + Аг) часть объема выделяющихся пузырей приходится на инертный газ, в результате парциальное давление рсо уменьшится, что, в свою очередь, приведет к сдвигу вправо равновесия реакции [С] + [О] = СОГ, и окисленность металла уменьшится.
Дата добавления: 2015-06-22; просмотров: 1329;
