Восстановление оксидов железа монооксидом углерода
Реакции восстановления оксидов железа:
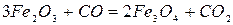 + 111 кДж/кг Fe (2.1‑1)
+ 111 кДж/кг Fe (2.1‑1)
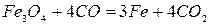 + 119 кДж/кг Fe (2.1‑2)
+ 119 кДж/кг Fe (2.1‑2)
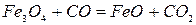 – 125 кДж/кг Fe при t>570OC (2.1‑3)
– 125 кДж/кг Fe при t>570OC (2.1‑3)
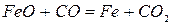 + 224 кДж/кг Fe при t>570OC (2.1‑4)
+ 224 кДж/кг Fe при t>570OC (2.1‑4)
Реакция 1. Окись железа соединение непрочное (см. упругость диссоциации). Реакция идет слева направо при любом содержании в газовой фазе СО и СО2 до полного израсходования одного из реагентов (возможна даже термическая диссоциация).
Реакции 2 и 3. Окисел Fe3O4 более прочный. Для его восстановления необходим избыток окиси углерода в газовой фазе. В противном случае углекислота окисляет FeO до Fe3O4. Для протекания реакций отношение СО2:СО не должно быть больше определенных значений.
Реакция 4. FeO является самым прочным оксидом железа. Для протекания прямой реакции необходим еще больший избыток СО и меньшее отношение СО2:СО в газовой фазе.
Отсюда следует, что для каждого окисла при данной температуре существует такое соотношение восстановителя и его окисла (СО и СО2) в газовой фазе, при котором газовая фаза является нейтральной по отношению к окислу железа и продукту его восстановления, а восстановительно-окислительная реакция находится в подвижном равновесии.
Так как объем газообразных продуктов реакции равен объему газа, вступающему в реакцию, состав равновесной газовой фазы не зависит от давления и меняется только с изменением температуры. Равновесные соотношения СО2:СО в газовой фазе установлены расчетами в соответствии с законами химической термодинамики и подтверждены экспериментально.
Равновесные составы газовой фазы с окислами железа и железом при разных температурах могут быть представлены следующей диаграммой (рис. 2.1‑3).
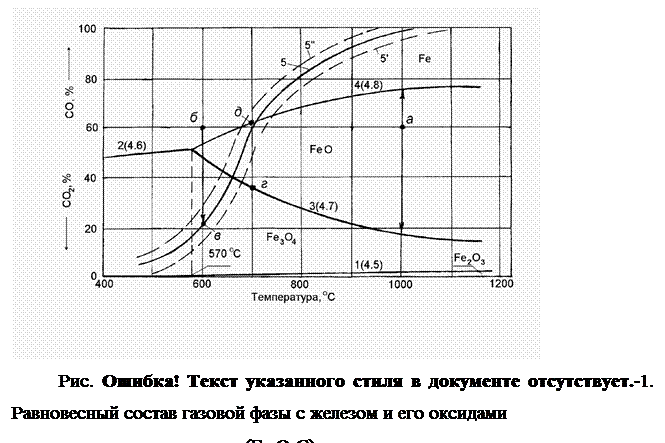 На оси ординат отложено содержание монооксида углерода (принято, что газовая фаза состоит из монооксида углерода и углекислого газа, поэтому в каждой точке ординаты сумма (СО2+СО) равна 100%.), а на оси абсцисс - температуры.
На оси ординат отложено содержание монооксида углерода (принято, что газовая фаза состоит из монооксида углерода и углекислого газа, поэтому в каждой точке ординаты сумма (СО2+СО) равна 100%.), а на оси абсцисс - температуры.
Равновесный состав газовой фазы реакции (1), необратимо протекающей при незначительном содержании СО, практически соответствует при любой температуре 100% СО2 в газовой фазе. Поэтому линия равновесия этой реакции как бы совпадает с осью абсцисс.
Равновесный состав газовой фазы реакции (2) с изменением температуры меняется по кривой 2. Равновесные составы газовой фазы реакций (3) и (4) изменяются соответственно по кривым 3 и 4. Причем кривая 3 нисходящая, а кривая 4 - восходящая. Это объясняется эндотермичностью реакции (3) (реакция протекает с затратами тепла, тепловой эффект реакции “-“) и экзотермичность реакции (4) (реакция протекает с выделением тепла, тепловой эффект реакции “+“). Повышение температуры в соответствии с принципом Ле Шателье смещает равновесие эндотермической реакции в сторону поглощения тепла, вызывает увеличение содержания СО2 и снижение содержания СО в газовой фазе (кривая 3 - нисходящая). Равновесие экзотермической реакции с повышением температуры сдвигается, наоборот, в сторону выделения тепла, увеличения содержания СО и уменьшения содержания СО2 в равновесной газовой фазе (кривая 4 -восходящая).
Таким образом, каждая точка на кривой характеризует равновесие одной из реакций восстановления.
Равновесные кривые делят диаграмму на три области устойчивых состояний: Fe3O4, FeO и Fe. При температурах ниже 570 ОС область FeO исчезает, происходит восстановление Fe непосредственно из Fe3O4.
Любая точка вне кривых 2-4 характеризует нейтральный состав газовой смеси при данной температуре по отношению к тому веществу (окислу или железу), которое устойчиво в области расположения точки. Оно не будет ни восстанавливаться, ни окисляться.
Для других веществ состав газа неравновесный, поэтому реакции пойдут в направлении образования того вещества, которое определяет название данной области.
Например, если в газ, содержащий 40% СО2 и 60% СО, при температуре 900 ОС поместить Fe, FeO и Fe3O4, то без изменения останется только FeO. Fe3O4 будет восстанавливаться до FeO, а Fe - окисляться до FeO, до тех пор пока не закончатся реагенты или состав газовой фазы не станет равновесным для данной реакции.
Анализ кривых равновесия реакций позволяет сделать следующие выводы:
- Для восстановления гематита достаточно невысокое содержание газа восстановителя;
- Восстановление FeO возможно лишь при высокой концентрации CO в газовой фазе. Причем с повышением температуры величина необходимого избытка восстановителя увеличивается;
- Газ, который не может быть использован для восстановления FeO, используется для восстановления Fe3O4 до FeO.
Восстановительные процессы в доменной печи не достигают рассмотренных равновесных состояний. Это обусловлено:
1. непродолжительным временем пребывания газа в печи
2. протеканием реакции взаимодействия углерода кокса и диоксида углерода кокса.
Реакция распада монооксида углерода газификации углерода кокса, получившая название «реакция Белла – Будуара» в честь ее исследователей, описывается уравнением:
5) 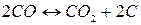 +166 мДж/кг С. (2.1‑5)
+166 мДж/кг С. (2.1‑5)
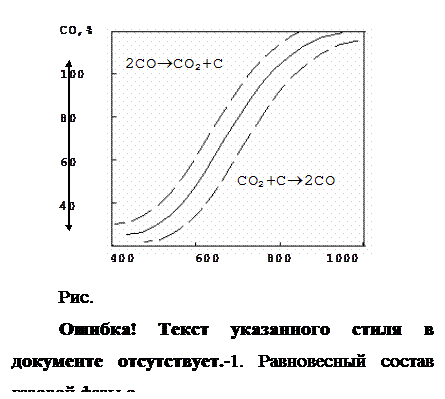 Реакция обратима, протекает с изменение объема газовой фазы. Равновесие данной реакции зависит от температуры и давления. Кривая равновесных составов газовой фазы реакции 5 представлена диаграммой (рис. 2.1‑4).
Реакция обратима, протекает с изменение объема газовой фазы. Равновесие данной реакции зависит от температуры и давления. Кривая равновесных составов газовой фазы реакции 5 представлена диаграммой (рис. 2.1‑4).
Кривая разделяет поле диаграммы на 2 области. В левой области реакция идет в сторону образования СО2 и сажистого С, в правой – в сторону образования СО. Реакция протекает с изменением объема газовой фазы. Поэтому с повышением давления равновесие реакции сдвигается в сторону увеличения содержания в газе углекислоты. Кривая смещается вправо, вниз.
Прямая реакция – реакция распада углерода протекает при низких температурах. Скорость реакция незначительна и для достижения равновесия необходимо длительное время. Реакция практически не оказывает влияния на состав газовой фазы и восстановительные процессы, протекающие в области низких температур.
Обратная реакция – реакция газификации углерода протекает при высоких температурах, отличается высокой скоростью и быстрым достижением равновесия. С ростом температур скорость этой реакции возрастает. Интенсивное развитие реакция получает при температурах 1000¼1100 ОС. Реакция оказывает значительное влияние на состав газовой фазы и восстановительные процессы, протекающие в нижней части шахты печи при высоких температурах.
Совмещение диаграмм, описывающих термодинамические условия равновесия в системах Fе–О–С и С–СО–СО2 позволяет сделать следующие выводы:
- Состав газа левой области препятствует течению восстановительного процесса, состав правой области - способствует.
- Из-за низких скоростей протекания реакции в левой области диаграммы, она не оказывает значительного влияния на восстановительный процесс. Все количество двуокиси углерода, которое образуется в результате рассмотренных реакций, при умеренных температурах (до 700…1000 ОС) ни с чем не взаимодействует и уносится газами из печи.
- Реакция оказывает существенное влияние на восстановительный процесс в правой области диаграммы. При температурах 900-1200 ОС весь, образующийся в результате восстановления железа, углекислый газ полностью расходуется по этой реакции.
В низкотемпературной зоне за время опускания материала восстановление Fe2O3, Fe3O4 и части FeO успевает завершиться. В высокотемпературной зоне в нормально работающей печи восстанавливается лишь часть FeO.
На основании сказанного можно просуммировать реакции 4 и 5, то есть реакции, протекающие в области высоких температур.
Результирующая реакция имеет вид:
 6)
6) 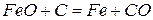 (2.1‑6)
(2.1‑6)
Дата добавления: 2015-06-22; просмотров: 4968;
