Місце квантової механіки в системі наук про рух тіл
Взагалі існує чотири механіки:
1. Класична механіка Ньютона-Галілея (XVII ст.) справедлива для випадків, коли швидкість тіла 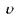 значно менша за швидкість поширення світла
значно менша за швидкість поширення світла 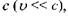 а маса тіла значно більша за масу електрона,
а маса тіла значно більша за масу електрона, 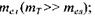
2. Механіка теорії відносності  описує рух тіла з швидкістю
описує рух тіла з швидкістю 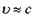 та масою
та масою 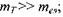
3. Квантова механіка без врахування ефектів теорії відносності, описує рух тіл з масою 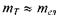 та швидкістю
та швидкістю 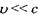 (нерелятивістська квантова механіка);
(нерелятивістська квантова механіка);
4. Релятивістська квантова механіка, справедлива для випадків, коли 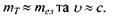
На початку XX ст. стало очевидним, що класична фізика невзмозі описати властивості систем, що складаються з мікрочастинок. Так, планетарна модель Резерфорда виявилась неспроможною пояснити лінійчастий характер атомних спектрів та сам факт стійкості атомів. З погляду класичної електродинаміки виняткова стійкість атомів суперечить ядерній моделі їх будови. Вихід був запропонований Бором: суперечності усувались шляхом введення припущень, що не задовольняли як закони класичної механіки, так і закони класичної електродинаміки. Йдеться про добре відомі постулати Бора, суть яких полягає в таких положеннях:
1. Із нескінченної множини електронних орбіт здійснюються лише дискретні "стаціонарні" орбіти, для яких момент кількості руху кратній до 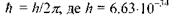 ,
, 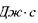 - стала Планка, тобто
- стала Планка, тобто 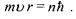
Рух електронів по стаціонарних орбітах не супроводжується випромінюванням.
2. Випромінювання або поглинання атомами електромагнітних хвиль відбувається при переході електронів з однієї стаціонарної орбіти до іншої. Частота хвиль, що випромінюється атомами при таких переходах, визначається різницею енергій стаціонарних станів до і після випромінювання згідно з таким рівнянням:
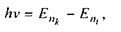
де 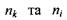 - номера стаціонарних орбіт, між якими відбуваються переходи електронів.
- номера стаціонарних орбіт, між якими відбуваються переходи електронів.
Таким чином, зберігаючи планетарну модель Резерфорда, Н. Бор вніс до неї ідеї квантової теорії Планка. Так була створена нова теорія - теорія Бора, яка стала наступним кроком в розвитку теорії будови атома. Теорія Бора не лише дала наочну картину руху електрона в атомі водню, а й дала змогу розрахувати можливі значення його енергії:
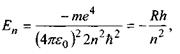 (7.1)
(7.1)
де 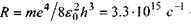 - стала Рідберга, а
- стала Рідберга, а 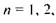 З, ... - номер орбіти.
З, ... - номер орбіти.
Згідно з теорією Бора, частоти, які випромінюють атоми водню, можуть бути визначені за формулою:
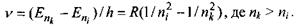 (7.2)
(7.2)
Ця формула є узагальненням формули Бальмера, одержаної ним експериментально:
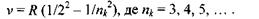
Однак успіх теорії Бора не можна було поширити на більш складні атоми. Слабкою стороною цієї теорії, що зумовила її подальші невдачі, була її внутрішня логічна суперечність - вона не була ні послідовною класичною, ні послідовною квантовою теорією. Потрібна була нова квантова теорія, яка описувала б поведінку і властивості мікрочастинок. Основою для створення такої теорії стали праці де Бройля, Гейзенберга і Шредінгера.
Дата добавления: 2015-06-22; просмотров: 727;
