Вторинна структура
Завдяки використанню прецизійного фізичного методу рентгеноструктурного аналізу вчені відкрили вторинну структуру макромолекул, яка полягає в тому, що поряд з лінійними ділянками в біополімерах були знайдені також ділянки, певним чином скручені в спіраль або в якусь іншу конформацію. Це явище локального впорядкування біопо-лімерних лацюгів було відкрито як для білків (Астбюрі, Полінг, Корі та інші; саме Полінг отримав Нобелівську премію за відкриття цієї тонкої структури білків), так і для нуклеїнових кислот (вже згадане вище відкриття спіральної структури ДНК Франкліном, Криком, Уотсоном і Уілкин-зом).
На рис. 4.8 зображена модель а-спіралі поліпептидного ланцюга білкової молекули, що закручена направо за стрілкою годинника. Основна причина утворення вторинної структури - це наявність водневих зв'язків між амінокислотними залишками. Виявилося, що на кожний крок спіралі приходиться 3.6 амінокислотних залишки, а через п'ять кроків спіралі (ця ділянка містить відповідно 18 амінокислот) конфігурація поліпептидного ланцюга повторюється. Просторовий період повторення  спіралі складає
спіралі складає 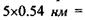
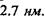 Напрямок водневих зв'язків в
Напрямок водневих зв'язків в  спіралі виявився паралельним до вісі спіралі. Стабілізація спіральної конформації відбувається завдяки водневим зв'язкам між групами
спіралі виявився паралельним до вісі спіралі. Стабілізація спіральної конформації відбувається завдяки водневим зв'язкам між групами 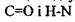 кожної першої і четвертої пептидної одиниці.
кожної першої і четвертої пептидної одиниці.
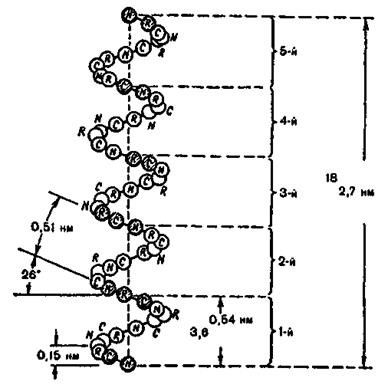
Рис. 4.8. Модель  спіралі білкової молекули.
спіралі білкової молекули.
Полінг і Корі встановили, що окрімі  спіралі в білках існують ще інші стійкі конформації поліпептидного ланцюга (наприклад, паралельна і антипаралельна
спіралі в білках існують ще інші стійкі конформації поліпептидного ланцюга (наприклад, паралельна і антипаралельна  форми тощо). Всі ці стійкі конформації поліпептидного ланцюга, що визначають вторинну структуру білків, зобов'язані своїм існуванням і стабільністю, як і у випадку спіралі, водневим зв'язкам
форми тощо). Всі ці стійкі конформації поліпептидного ланцюга, що визначають вторинну структуру білків, зобов'язані своїм існуванням і стабільністю, як і у випадку спіралі, водневим зв'язкам  .
.
Вторинна структура нуклеїнових кислот (зокрема, ДНК) пов'язана, як вже згадувалося, з наявністю подвійної спіралі, яка складається з двох полінуклеотидних ланцюгів. У цих взаємно перевитих спіральних ланцюгах пуринові азотисті основи одного ланцюга з'єднані водневими зв'язками з відповідними піримідиновими азотистими основами другого ланцюга. З'єднання азотистих основ відбувається за таким правилом Чаргаффа: незважаючи на те, що кількість азотистих основ А, Г, Т, Ц може змінюватися
досить в широких межах від виду до виду, але завжди кількість пуринових основ в точності дорівнює кількості піримідинових основ. Точніше кажучи, аденін і гуанін в одному ланцюгу пов'язані у строгій відповідності з тиміном і цитозином в другому ланцюгу, утворюючи так звані "уотсон-криківські пари" АТ і ГЦ (рис. 4.9).
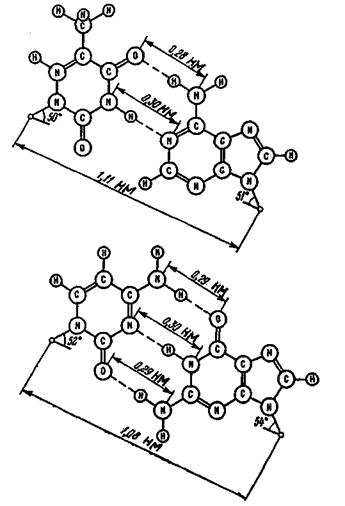
Рис. 4.9. "Уотсон-криківські пари" в подвійній спіралі ДНК.
Слід зазначити, що в парах азотистих основ АТ і особливо в парах ГІД значна роль належить диполь-диполь-ним (Ван-дер-Ваальсівським) взаємодіям. Ці взаємодії стають дуже помітними, коли подвійна спіраль розділяється з утворенням двох окремих ланцюгів. При цьому водневі зв'язки між азотистими основами замінюються на зв'язки з молекулами води.
Температура плавлення ДНК  може бути апроксимо-вана такою формулою:
може бути апроксимо-вана такою формулою:
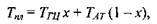
де 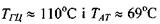 - температура плавлення відповідно до пар ГЦ і АТ, а х - концентрація (мольна частка) пар ГЦ в ДНК.
- температура плавлення відповідно до пар ГЦ і АТ, а х - концентрація (мольна частка) пар ГЦ в ДНК.
Окремі (розділені) поліпептидні ланцюги скручуються в клубки. Цей процес називають фазовим переходом спіраль-клубок, або денатурацією. Він відбувається не лише при нагріванні, а й при додаванні кислот, спиртів та деяких інших хімічних сполук.
Дата добавления: 2015-06-22; просмотров: 1076;
