I.Описание установки.
ОПРЕДЕЛЕНИЕ ПОКАЗАТЕЛЯ АДИАБАТЫ
МЕТОДОМ КЛЕМАНА-ДЕЗОРМА
Цель работы:определить показатель адиабаты для воздуха.
I.Описание установки.
Для определения показателя адиабаты используется установка Клемана-Дезорма, схема которой приведена на рис. 1.1.
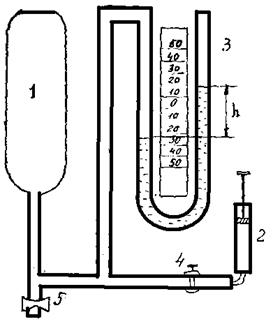
Рис. 1.1 Установка Клемана-Дезорма
К баллону 1 емкостью 10-15 л, в котором находится испытываемый газ, через кран 4 подключен насос 2, позволяющий увеличить давление по сравнению с атмосферным. Превышение давления измеряется с помощью U-образного манометра 3 по разностям уровней h жидкости в коленах. Кран 5 служит для кратковременного выпуска газа.
II. Методика работы
Если в баллон накачивают газ (например, воздух) до давления Р1, большего, чем Р0, то состояние газа характеризуется параметрами P1, V1, T1 и соответствует точке 1 на P-V диаграмме (рис. 1) (Внимание! Здесь и далее буквой V обозначается удельный объем, т.е. объем, занимаемый единицей массы газа. Это удобно для расчетов, т.к. по условиям опыта масса газа в сосуде будет изменяться.)
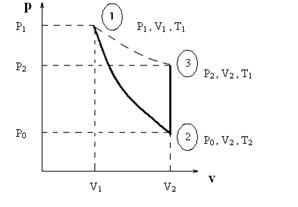
Рис. 1.2. P-V диаграмма газовых процессов.
Если на короткое время открыть кран баллона, то часть газа выйдет, а давление внутри баллона снизится до атмосферного Р0. При этом расширение газа, вследствие кратковременности его протекания, можно считать адиабатическим, т.е. происходящим без теплообмена с окружающей средой; такой процесс называют также изоэнтропийным, т.к. при нем не происходит изменения энтропии. Новое состояние газа будет характеризоваться параметрами P0 , V2, T2 (точка 2 на рис. 1). Так как, согласно первому началу термодинамики, работа газа при адиабатическом процессе совершается за счет убыли его внутренней энергии, то температура газа при этом понижается, т.е. Т2 < Т1. Переход из состояния «1» в состояние «2» описывается уравнением Пуассона для адиабатического процесса, следовательно:
P1V1g = P0 V2g, (1.1)
где g - показатель адиабаты, причем по определению он равен:
g = Cp/Cv , (1.2)
где Cp – теплоемкость газа при постоянном давлении,
Cv – теплоемкость газа при постоянном объеме.
(Напомним, что молярной теплоемкостью называется количество теплоты, которое нужно, чтобы нагреть 1 моль вещества на 1 К.)
Для идеального газа молярные теплоемкости Cp и Cv связаны уравнением Майера:
Cp=Cv+R, (1.3)
где R=8,31 Дж/(моль К) – универсальная газовая постоянная; отношение Cp/Cv = (i + 2)/i, (1.4)
где i – число степеней свободы молекул исследуемого газа: для одноатомного газа i=3, для двухатомного i=5, для многоатомного i=6.
Через некоторое время после закрытия крана оставшийся в баллоне газ нагреется при постоянном объеме до температуры окружающей среды Т1. При этом его давление повышается до значения Р2 (точка 3 на рис. 1). В методе Клемана-Дезорма измерение давления производят с помощью U-образного манометра (см. рис. 2); перепад h уровней жидкости в коленах манометра позволяет определить значения давления газа в баллоне Р1 и Р2 соответственно:
P1 = P0 + h1 ; P2 = P0 + h2 (1.5)
Конечное (точка 3) и начальное (точка 1) состояния газа соответствуют одной и той же температуре Т1 и связаны уравнением Бойля-Мариотта для изотермического процесса:
P1V1 = P2 V2. (1.6)
Чтобы получить формулы, связывающие показатель адиабаты с измеряемыми параметрами, возведем уравнение (1.5) в степень g и разделим его почленно на уравнение (1.1):
P1g V1g/(P1V1g )= P2g V2g/(P0 V2g), или P0 / P1 = (P2 / P1) g, (1.7)
Логарифмируя уравнение (1.7), находим:
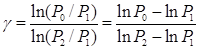 (1.8)
(1.8)
Выразим давление газа через разность уровней жидкости в манометре, подставляя (1.5) в уравнение (1.8). Получим
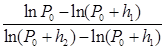 , (1.9)
, (1.9)
или после преобразований:
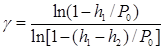 (1.10)
(1.10)
Отношения h1/P0 и (h1 –h2)/P0 значительно меньше единицы, поэтому, используя приближенную формулу ln(1-x) @ x при малых значениях х, получим из (1.10)
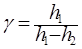 (1.11)
(1.11)
Эта формула является расчетной для определения показателя адиабаты g.
Дата добавления: 2015-06-22; просмотров: 1848;
