Классификация хим.реакторов.
1). По гидродинамическим условиям:
- реактор смешения
- реактор вытеснения.
Реактор смешения – это реактор в котором раб. среда перемешивается мешалкой или циркуляционным насосом.
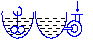
Реактор вытеснения – это реактор имеющий форму удлинённого канала в котором раб. среда перемешивается в ограниченном объёме за счёт колебаний среды.
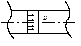
Колебания и завихрения создаются за счёт неодинаковой скорости потока по сечению реактора.
Идеальное смешение , когда в реакторе в любой точке его объёма все параметры (t,P, концентрация и т.д.) не изменяются во времени, т.е. остаются постоянными.
Идеальное вытеснение – это когда в реакторе раб. среда движется как твёрдый поршень и все параметры (t,P, концентрация и т.д.) изменяются вдоль реактора по одной зависимости.
Реальные реакторы с некоторыми допущениями можно принять за идеальные.
2). По условиям теплообмена:
При хим. реакции выделяется или поглощается тепло. Физ-е явления: растворения, кристаллизация, испарения, сопровождаются также выделением или поглощением тепла.
Если внутр. тепло в реакторе расходуется на хим. реакцию и теплообмен реактора с окружающей средой отсутствует, то такой реактор наз. адиабатическим.
Если в реакторе поддерживается постоянная температура за счёт теплообмена с окружающей средой, то такой реактор наз. изотермическим.
Если в реакторе необходимая температура поддерживается только за счёт теплоты хим. реакции, то такой реактор наз. автотермическим.
3). По фазовому составу:
Реакторы гомогенных процессов и гетерогенных процессов.
В гомогенных реакторах среда находится в одной фазе. Пример: газовые, жидкостные.
В гетерогенных реакторах присутствуют системы:
г-ж, г-тв, ж-тв.
4). По способу организации процессов:
- периодические; непрерывные и полунепрерывные (полупериодические).
Периодические процессы характеризуются:
- изменением параметров среды во времени (t,P, концентрация и т.д.).
- Протекание процесса в несколько стадий.
Непрерывный процесс характеризуется:
- вводом исх.веществ в реактор и выводом готовых продуктов из реактора.
Полупериодический характеризуется тем, что один исх.продукт загружается непрерывно, другой периодически.
5). По изменению параметров процессов во времени: стационарный и не стационарный режим.
Стационарный режим хар-ся тем, что когда в одной точке реактора произвольный момент времени, параметры процесса не изменяются (t,P, концентрация и т.д.).
Не стационарный режим – это когда произвольно выбранные точки объёма реактора, параметры процесса изменяются во времени.
Стационарный режим характерен для непрерывных процессов,
а нестационарный для периодических процессов.
6). По конструктивным характеристикам:
- ёмкостные, автоклавы, камерные реакторы, горизонтальный и вертикальный конвектор.
- реакторы теплообменного типа.
- реакторы типа реакционной печи, шахтные, полочные, камерные, вращающиеся печи.
Классификация хим.реакций.
1). По фазовому составу:
- гомогенные. Среды в одинаковой фазе.
- гетерогенные. Среды в разных фазах.
2). По механизму протекания: простые и сложные.
Простые реакции протекают в одном направлении и в одну стадию.
А® R или А+В ® R
А,В - исх.продукт.
R – готовые продукты.
Сложные состоят из простых реакций.
К ним относятся: а). параллельные А®R, В®R
Б). последовательные: А®В®R
В). Сопряжённые, когда хим.реакция протекает самопроизвольно, а другая только в присутствии
первой.
Г). Комбинация выше перечисленных.
Д). Обратимые: А«R
3). По молекулярности:
- мономолекулярные
- бимолекулярные
-тримолекулярные
4). По порядку:
- Порядок хим.реакции – это сумма показателей у степеней концентрации в ур - ии выражающим скорость хим.реакции в зависимости от концентрации.
аА + вВ® rR + sS
r/= 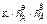
n=а+в
А,В –исх.продукт
R,S – готовые продукты
r/- скорость хим.реакции
К- константа скорости хим.реакции
n- порядок хим.реакции
Хим.реакции бывают: первого, второго, третьего и дробного порядка.
Если концентрация одного из веществ находится в избытке и входе реакции изменяется незначительно, то порядок n реакции снижается и ур-е (r/) упрощается.
5). По применению катализаторов:
- каталитические с катализатором
- не каталитические без катализатора
6). По тепловому эффекту:
- экзотермические
-эндотермические
Экзотермические протекают с выделением тепла (DТ>0) и уменьшением энтальпии (DН<0).
Эндотермические протекают с поглощением тепла (DТ< 0) и увеличением энтальпии (DН>0).
3.Технологический критерий эффективности химико – технологического процесса.
1).Степень превращения – это доля исх.вещ-ва затраченного в ходе хим.реакции.
Для реакции А® R
ХА= nАО - nА/nАО, где nАО- кол-во исх.вещ-ва в начале реакции.
nА – кол-во реагента А в начале процесса.
ХА=DnА/nАО
0£Х£1 . Если реакционный объём не меняется в ходе реакции (объём реактора), то степень превращения можно выразить, через концентрацию.
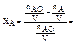
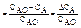
САО,СА- начальная и конечная концентрация реагента А.
V- объём реакционной смеси или объём реактора.
2). Выход продукта , ФА – это отношение реально полученного продукта к максимальному выходу.
Максимальный выход продукта можно определить по стехиометрическому уравнению Для реакции А® R
ФА= nR/nRmax, где nR – реально полученный выход R.
Rmax – максимальный выход.
3). Селективность, j
Селективность – это отношение кол-ва целевого продукта к общему кол-ву готовых продуктов.
Для параллельной реакции.
А® R
¯ S
А – исх.продукт.
R,S- готовые продукты.

4). Производительность – это кол-во готового продукта полученного в единицу времени.
П=nR/t для реакции из А® R
t- время.
П= СRּuR(кг/с).
СR-концентрация готового продукта.
uR- скорость выхода готового продукта.
Максимальная производительность наз.мощностью.
5). Интенсивность (I) – это производительность отнесена какой-нибудь геометрической хар-ки реактора ( объёму (кг/м3, поперечному сечению кг/сּм2).
Дата добавления: 2015-06-17; просмотров: 892;
