Виды огнеупорных материалов
Поскольку огнеупорные материалы имеют высокие температуры плавления, они, видимо, характеризуются прочными химическими связями. Причем химические связи могут быть как ионного, так и ковалентного типа. Огнеупорные вещества с ионным характером связи должны иметь высокую энергию кристаллической решетки. Из уравнения (8.19) следует, что энергия кристаллической решетки пропорциональна следующемуотношению
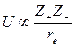
где Z+ и Z_— заряды ионов, а rе – расстояние между анионом и катионом. Величина энергии U в основном определяется произведением зарядов ионов Z+ Z-. Например, энергия кристаллической решетки щелочноземельного металла примерно в четыре раза выше энергии решетки галогенида щелочного металла, имеющего ту же кристаллическую структуру (например, типа поваренной соли) и близкие значения rе. Качественно эта же закономерность проявляется и в величинах температур плавления, например NaCl плавится при 800°С, a MgO – при 2800°С. Таким образом, общим условием существования ионных материалов с высокими температурами плавления является присутствие в них одного, а еще лучше двух многозарядных ионов. Примерами таких материалов являются А12О3, Сг2О3 и ZrO2.
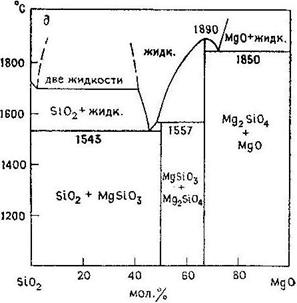
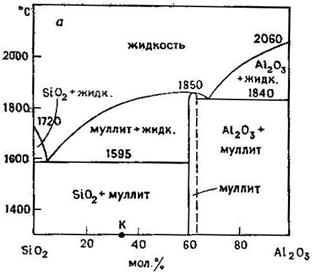
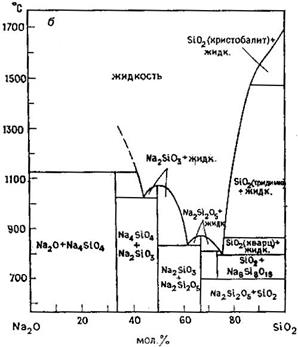
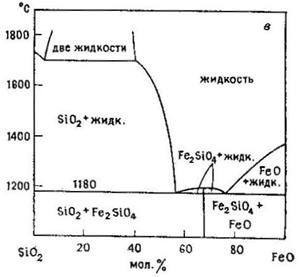
Рис. 20.3. Диаграммы состояния систем Al2O3–SiO2 (а), Na2O–SiO2 (б), FeO–SiO2 (в), Fe3O4–SiO2 (г) и MgO–SiO2 (д). [Phase Diagrams for Ceramists, American Ceramic Society, 1964, 1969, 1975 гг.].
Влияние rе на жаростойкость может быть прослежено при сравнении температур плавления оксидов щелочноземельных металлов. Все они (за исключением ВеО) имеют кристаллическую решетку типа NaCl:
Оксид MgO CaO SrO BaO
Tпл, °С 2800 2580 2430 1923
Наибольшее значение rеи, следовательно, наименьшее значение U в этом ряду имеет ВаО. Это коррелирует с тем, что температура плавления ВаО самая низкая.
Аналогичные рассуждения применимы к огнеупорным веществам с ковалентным характером связи. Прочные химические связи в этих веществах — причина образования ими каркасной структуры. Соединения одновалентных элементов, например галогенов, по-видимому, не могут быть использованы в качестве огнеупорных материалов либо из-за их летучести, либо из-за низких температур плавления. Например, в А1С13 (Тпл 190°С) каждый атом хлора связан с шестью атомами алюминия и каждая из связей А1—Cl слабая. Поэтому AlCl3 и подобные ему вещества имеют низкие температуры плавления. Ковалентные соединения, пригодные для использования в качестве огнеупоров, должны отличаться прочными химическими связями. Они, как правило, содержат многовалентные элементы с примерно одинаковой электроотрицательностью и небольшими координационными числами (обычно КЧ 4). Эти соединения имеют каркасную структуру. Ниже приведены примеры возможных огнеупорных материалов и их температуры плавления:
SiC Si2N4 BN В4С NbB2
Тпл, °С 2700 ~1900 ~3000 ~2350 ~ 2900
HfN HfC TaN TaC ZrC
Тпл,°С 3305 3890 3360 3880 3540
(В перечень включен и HfC – одно из наиболее тугоплавких веществ, известных в настоящее время.)
Выше шла речь в основном о материалах, которые в принципе можно использовать в качестве огнеупоров. Широкое промышленное применение в настоящее время имеют главным образом кремнеземистые, хромомагнезитовые, шамотовые и высокоглиноземистые огнеупорные материалы. Другие тугоплавкие вещества, такие, как SiC и Si3N4, имеют более специфические области применения.
Основным сырьем для производства динасового кирпича является кварцит, в который для облегчения спекания добавляют 2—3% СаО. При этом из сырья необходимо удалить такие примеси, как оксиды щелочных металлов, так как они обладают высокой флюсующей активностью (рис. 20.3, б). Одна из проблем, возникающих при эксплуатации динасовых кирпичей, – их частичное разрушение из-за изменения объема, которым сопровождается полиморфное превращение кварца (α  β) при 573°С. Это разрушение проявляется в виде растрескивания. Выше 573°С кирпичи вполне устойчивы и механически прочны вплоть до температур плавления (~1700°С). Из-за высокой вязкости расплавленного оксида кремния за время эксплуатации в кирпичах может накапливаться значительное количество жидкой фазы.
β) при 573°С. Это разрушение проявляется в виде растрескивания. Выше 573°С кирпичи вполне устойчивы и механически прочны вплоть до температур плавления (~1700°С). Из-за высокой вязкости расплавленного оксида кремния за время эксплуатации в кирпичах может накапливаться значительное количество жидкой фазы.
После обжига многие виды глин становятся жаростойкими. Чистый каолин (известный также как фарфоровая глина) имеет примерный состав Al2O3·2SiO2·2H2O. Его свойства при высоких температурах можно объяснить с помощью диаграммы состояния системы А12O3–SiO2 (рис. 20.3,а). После потери воды и последующей рекристаллизации материала каолин превращается в смесь муллита и кремнезема состава, примерно отвечающего точке К. Плавление этой смеси начинается при температуре ~1595°С, заканчивается при ~1800°С. В монтмориллонитовых же глинах, таких, как бентонит, где отношение оксида кремния к оксиду алюминия гораздо выше (~4 : 1), содержится значительное количество других катионов, в том числе и катионы щелочных металлов. Комбинация этих двух факторов приводит к понижению температуры плавления материала до ~1300°С и, следовательно, к понижению жаростойкости бентонита.
Высокоглиноземистые огнеупорные материалы обычно содержат >85 масс. % А12О3; SiO2 присутствует в них в виде главной примеси. Эти материалы изготавливают из диаспора или боксита. Согласно диаграмме состояния системы А12О3–SiO2 (рис. 20.3, а), в равновесных условиях ниже температуры солидуса (<1840°С) в них сосуществуют две фазы: корунд А12О3 и муллит 3А12О3–2SiО2. Выше 1840°С происходит частичное плавление смеси фаз с образованием А12О3 и жидкости. Известны две различные технологии изготовления высокоглиноземистых огнеупорных кирпичей. Переплавленный оксид алюминия получают путем плавления в электрических печах при ~2000°С. Футеровкой печей служит сама загружаемая шихта. Спеченные глиноземистые кирпичи изготавливают путем обжига при 1700–1800°С. При таких пониженных температурах проводят спекание оксида алюминия, содержащего значительное количество примесей, причем спекание происходит с участием жидкой фазы. Получающийся продукт отличается низкой пористостью и устойчивостью к истиранию. Спекание высокочистого оксида алюминия, содержащего >99,8% Аl2О3, протекает по твердофазному механизму. При этом в А12О3 обычно вводят ~0,2% MgO. Хотя действие этой добавки не вполне понятно, получающийся в результате продукт характеризуется нулевой пористостью и оптической прозрачностью. Способы получения жаростойких высокоглиноземистых бетонов описаны в гл. 19.
Магнезиальные и хромомагнезитовые огнеупорные материалы широко используются в качестве футеровки металлургических печей. Это объясняется их устойчивостью к действию расплавленных шлаков. MgO плавится при 2800°С, его можно получить из брусита Mg(OH)2, магнезита МgСО3 или доломита СаСО3-MgCO3. Сырье обжигают (т. е. нагревают) при 500— 1000 °С. В ходе термического разложения выделяются СО2 и Н2О и образуется высокодисперсный порошок «активного» MgO. «Активный» MgO характеризуется большой удельной поверхностью и гигроскопичностью. Образующийся при взаимодействии MgO с водой Mg(OH)2 имеет более низкую плотность, чем оксид магния. Если гидратация MgO идет в процессе его эксплуатации, то увеличение объема изделия ведет к разрушению последнего. Такое разрушение можно предотвратить путем предварительного прокаливания MgO, т. е. путем нагревания MgO до достаточно высоких температур с целью увеличения средних размеров зерен и получения хорошо спеченного материала с низкой пористостью. Температуру предварительной прокалки варьируют от 1400 до 1700°С в зависимости от содержания примесей в MgO.
Для получения плотной прозрачной магнезиальной керамики и для улучшения спекания к ней добавляют LiF. В процессе спекания LiF улетучивается, а оставшийся чистый оксид магния вполне пригоден для использования при высоких температурах. Промышленные магнезиальные огнеупорные материалы содержат в виде примесей СаО, Аl2О3, Fе2О3 и поэтому в ходе прокалки происходит частичное плавление огнеупоров. Заметное облегчение спекания MgO (которое проводят при умеренных температурах), видимо, связано с появлением жидкой фазы, а также о образованием твердых растворов на основе периклаза (MgO), в которых часть атомов магния замещается атомами алюминия и железа.
Использование в качестве исходного сырья доломита приводит к некоторым неприятным последствиям. Дело в том, что после обжига доломита образуется весьма гигроскопичная смесь оксидов с высоким содержанием оксида кальция. Прокаливание образовавшегося материала лишь незначительно снижает его склонность к гидратации. Для борьбы с этим явлением используют два метода: во-первых, обожженный продукт можно покрывать специальной смолой, надежно изолирующей поверхность материала, во-вторых, в керамику вводят добавки, которые при нагревании связывают свободный оксид кальция. В качестве такой добавки можно использовать серпентин 3MgO–2SiO2–2H2O, который взаимодействует с СаО с образованием Ca3SiO5 (и форстерита Mg2SiO4).
Хромомагнезитовые огнеупорные материалы применяют для футеровки доменных печей. Оксид хрома Сг2О3 является жаростойким соединением с температурой плавления 2275°С. В природе в состав хромовых руд обычно входит ряд других оксидов. Как правило, хром присутствует в виде шпинелей АВ2О4, где А – магний и железо(II), а В – алюминий, железо(III), а также хром. Второй сопутствующей фазой в хромовых рудах является фаза, близкая по составу серпентину. При нагревании хромовых руд до ~1400°С серпентин теряет воду, а все железо(II) окисляется до Fe2O3. Последний может взаимодействовать с MgO из серпентина с образованием дополнительного количества шпинельной фазы. При этом серпентин обедняется оксидом магния и возникает менее жаропрочная богатая SiO2 жидкая фаза. Поэтому добавление MgO к хромомагнезитовым огнеупорам прежде всего необходимо для удаления этой богатой SiO2 жидкой фазы путем ее взаимодействия с MgO, в результате образуется более жаропрочная фаза – форстерит Mg2SiO4 (рис. 20.3, д).
Кроме перечисленных выше областей применения огнеупорных материалов, некоторые из них, имеющие строго контролируемое содержание примесей, находят применение в особых отраслях техники. Так, упоминавшийся ранее спеченный оксид алюминия используют, например, при изготовлении свечей зажигания, гнезд клапанов, обжимных устройств для волочения проволоки и т. п. Муллит, получаемый по реакции А12О3 (боксит или байерит) с SiO2 (кварц или фарфоровая глина), используют для производства тиглей, трубок пирометров и т. п. Форстерит, плавящийся при 1890°С, применяют в качестве формовочного песка при разливке стали. Форстерит встречается в виде минерала, в котором магний частично замещен на железо(II). Он может быть получен путем прокаливания MgO с тальком 3MgO–4SiO2–H2O или более часто с серпентином 3MgO–2SiO2–2H2O. Изделия из стеатита получают из смеси талька и глины. Их используют в качестве электроизоляционных материалов. Количество глины, необходимое для получения стеатита, невелико, и основным продуктом прокалки является клиноенстатит – одна из полиморфных модификаций MgSiO3. Другой ценный электрокерамический материал – кордиерит 2MgO-2Al2O3–5SiO2, имеющий очень низкий коэффициент термического расширения и, следовательно, проявляющий устойчивость к резким изменениям температуры. Его можно также получить из смеси талька с глиной путем введения небольших добавок А12О3 или силлиманита Аl2SiOз.
Диоксид циркония ZrO2 – весьма перспективный огнеупорный материал, температура плавления которого составляет ~2700°С. Однако при нагревании он часто растрескивается из-за изменения объема, которое сопровождает переход моноклинной модификации ZrO2 в тетрагональную. Моноклинный ZrO2, имеет плотность 5,56 г/см3, а более высокотемпературная тетрагональная фаза – 6,10 г/см3. Поэтому при нагревании происходит сжатие материала на 9% его объема. Фазовый переход и, следовательно, растрескивание можно предотвратить путем добавления 10–20% СаО, MgO или Y2O3. Эти добавки стабилизируют кубическую высокотемпературную модификацию ZrO2 (устойчивую в отсутствие добавок лишь при температурах выше 2400°С). Образующиеся твердые растворы стабильны при гораздо более низких температурах, чем чистый ZrO2. Формулу твердого раствора на основе оксидов циркония и кальция можно записать в виде CaxZr1-xO2-x. Такая запись предполагает, что замещение Zr4+ на Са2+ идет с образованием кислородных вакансий (гл. 10). При циклическом нагревании – охлаждении стабилизированный диоксид циркония обратимо расширяется и сжимается. Фазовых переходов, разрушающих керамику, при этом не происходит. Такой диоксид циркония широко применяется в качестве твердого электролита в высокотемпературных электрохимических источниках тока и в кислородселективных электродах; применение стабилизированного диоксида циркония в качестве твердого электролита связано с высокой подвижностью в нем кислородных вакансий (гл. 13).
Циркон ZrSiO4 имеет низкий коэффициент термического расширения, поэтому он выдерживает резкие колебания температуры. Этот материал используют для футеровки стекловаренных печей и в качестве формовочного песка. β-Глинозем— полиалюминат натрия состава Na2O-(7-9)А12О3 – образуется при взаимодействии А12О3, входящего в состав футеровки стекловаренных печей, с Na2O, содержащимся в расплавленном стекле. В настоящее время β-глинозем вызывает повышенный интерес в связи с высокой подвижностью в нем ионов Na+. β-Глинозем используется в качестве твердого электролита в твердофазных электрохимических источниках тока нового типа (гл. 13).
Многие неоксидные материалы имеют весьма высокие температуры плавления. Тем не менее их использование в качестве огнеупоров ограничено возможным окислением и высокими финансовыми затратами нa производство. Один из наиболее перспективных в этом отношении материал – нитрид кремния Si3N4, который можно использовать до температур ~1400°С. При высоких температурах он сохраняет высокую прочность позволяет изготавливать из него лопасти турбин и подшипники, работающие при высоких температурах. Карбид кремния SiC широко распространенный материал, устойчивый на воздухе до ~1700°С (благодаря образованию защитной поверхностной пленки SiO2). Его используют в качестве абразивных материалов (карборунд), нагревательных элементов электрических печей, при изготовлении массивных огнеупорных конструкций. Карборундовые огнеупорные материалы отличаются низкой пористостью, высокой теплопроводностью, они прекрасно выдерживают резкие колебания температуры. Отличный огнеупорный материал – синтетический графит, который весьма устойчив к действию шлаков и расплавленных металлов, за исключением металлов группы железа. Он обладает высокой прочностью, хорошей тепло- и электропроводностью. Эти свойства позволяют использовать синтетический графит в качестве электродов промышленных печей. Дисилицид молибдена MoSi2 используют для изготовления нагревательных элементов электрических печей, в которых создаются температуры до 1600°С. Устойчивость этого материала к окислению связана с образованием на воздухе защитной поверхностной пленки SiO2.
Дата добавления: 2015-06-17; просмотров: 4335;
