Энергетический баланс.
Все основные химико-технологические процессы сопровождаются поглощением или выделением тепла, изменением температуры и совершением работы над содержанием реактора или против внешних сил.
Тогда согласно закону сохранения и превращения энергии можно написать уравнение энергетического баланса.
E- + U- + A- = E+ + U+ + A+
E- – подведенная энергия
U- – внутренняя энергия входных потоков
A- – работа, совершаемая над системой
E+ – отведенная энергия
U+ – внутренняя энергия выходных потоков
A+ – работа системы
Частный случай энергетического баланса - тепловой
Тепловой баланс составляется на основе материального баланса и имеет цель определить потребности в расходе тепла на химические процессы.
Приходная Расходная
Q1 + Q2 + Q3 = Q4 + Q5
Q1 – физическое тепло веществ вступающих в реакцию
Q2 – тепло реакции
Q3 – тепло вносимое из вне
Q4 – физическое тепло продуктов
Q5 – потери тепла
Выход продукта.
Это главное для чего составляется материальный баланс.
Выход продукта для различных процессов определяется по разному:
– выход по массе
– выход по току
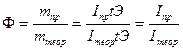
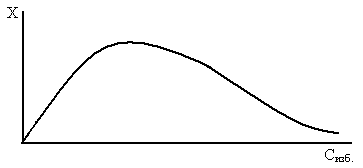
У необратимых реакций, когда возможно полное превращение веществ, Х=1, и это условие выполняется лишь во времени.
У равновесных реакций Х<1 т.к. равновесие наступает при неполном превращении вещества, и выход будет зависеть от условий проведения процесса.
Для увеличения производительности и выхода продукта в реакцию вводят избыток одного из реагирующих веществ (обычно дешевого) и смещают равновесие, но это до определенного предела:
Выход вещества от температуры изменяется по следующим закономерностям
A + B  D – Q A + B
D – Q A + B  D + Q
D + Q

Влияние на Ф, Х, φ основных параметров химико-технологического процесса (Т, τ, р).
1. Влияние температуры
а. Простая необратимая реакция Ф = X
A → B A + B → D
Для этого случая увеличение температуры приводит к увеличению Ф
Для обратимых A + B  C + D, A
C + D, A  B все зависит от Q
B все зависит от Q
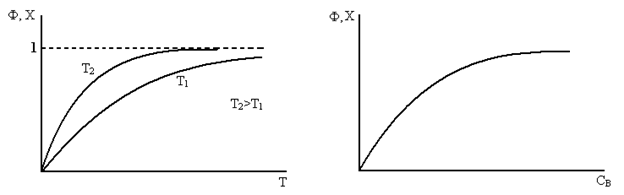
а) Экзотермическая реакция
влияние T на кинетический фактор и термодинамику противоречиво
При повышении температуры увеличивается константа скорости реакции и уменьшается X
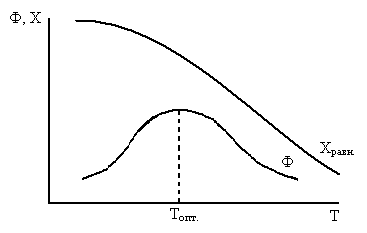
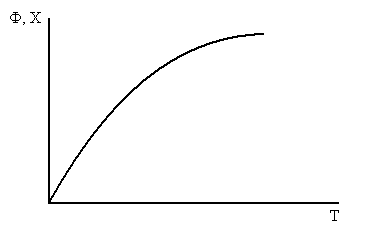
б) Эндотермическая реакция
при увеличении T происходит увеличение Кн, Кс
в) сложная реакция D  A
A  B
B
| 
|
| E2>E1 | E2<E1 |
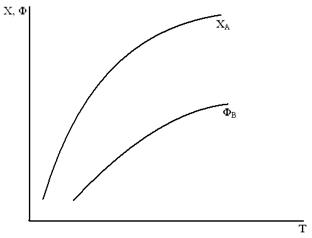
Зависимость Ф = f(τ)
1. A → B, A  B
простая необратимая и обратимая реакции B
простая необратимая и обратимая реакции
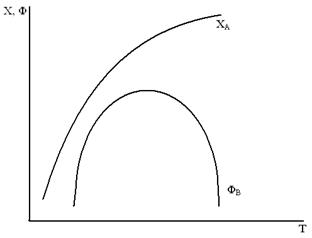
| 2. D  A A  B
сложнопараллельные реакции B
сложнопараллельные реакции
|
|  K1>K2
K1>K2
|
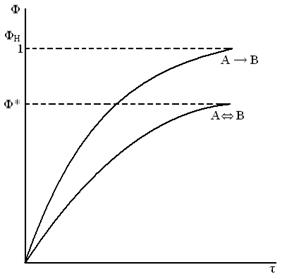
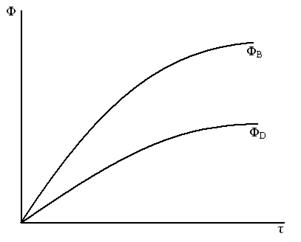
3. Сложно последовательные реакции Ф = f( 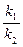 ), (τ)
), (τ)
A 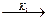 B
B 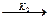 D
D
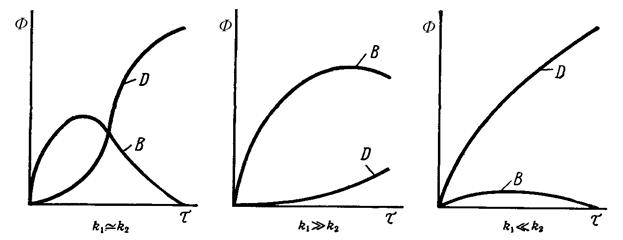
Это особенно в органическом синтезе: неполное окисление спиртов, алканов
CH3OH → CH3O → CO2 + H2O или неполного гидрирования
CO + 2H2  CH3OH
CH3OH
Дата добавления: 2015-06-17; просмотров: 853;
