СТРОЕНИЕ ДИЭЛЕКТРИКА.
Диэлектриками (изоляторами) называют вещества, в которых почти все электроны удерживаются на орбитах вокруг положительных ядер атома. Таким образом, у диэлектрика нет свободных электронов. Естественно, что в этом случае диэлектрик не пропускает электрический ток.
Каждый из нас лепил в детстве из пластилина, вырезал бумажные фигурки и склеивал их между собой, пришивал пуговицу… Так или иначе, все мы понимаем, что объекты окружающего нас мира удерживаются вместе не “абы как”, а с помощью каких-то дополнительных сил. Эти силы заметно различаются в зависимости от своей природы: в одном случае это нитка, соединяющая вместе кусочки ткани, в другом – всемирное тяготение, в третьем – клей, глина и т.п.
В мире атомов и молекул роль такого универсального “клея”, связывающего их между собой, выполняет химическая связь. Природа химической связи объясняется силой электрического притяжения между отрицательными электронами и положительными ядрами. Подобно тому, как разные виды клея различаются прочностью, сила химической связи также неодинакова для разных веществ. Об этом свидетельствует наш повседневный опыт: одни вещества легко разрушаются при малейшем воздействии (например, соль растворяется воде), так как связи между их атомами очень слабы. Атомы других веществ связаны сильнее, но и они поддаются деформации (например, металлы, которые можно гнуть и ковать); третьи же вещества (алмаз) настолько прочны, что им нипочем ни сверхвысокие температуры, ни давление. Соль, металл и алмаз являются яркими представителями трех наиболее характерных типов химической связи – ионной, металлической и ковалентной. Обратите внимание, насколько тип связей между атомами и молекулами вещества влияет на его физические и химические свойства. Атомы вступают в химические связи с единственной целью: приобрести устойчивую электронную конфигурацию.
Напомним, что химическая связь объясняется стремлением атомов приобрести устойчивую электронную конфигурацию, подобную конфигурации “ближайшего” к ним инертного газа. Рассмотрим некоторую последовательность элементов в таблице Менделеева, среди которых имеется неон (1s12s22p6). В скобках рядом с символом элемента указано число электронов в K*, L* и М_оболочках. F(2.7); Ne(2.8); Na (2.8.1) Атом натрия может приобрести устойчивую электронную конфигурацию неона, избавившись от одного электрона. Образовавшаяся частица – положительно заряженный ион натрия. У фтора на один электрон меньше, чем у неона.
Следовательно, если фтор присоединит один электрон (например, от атома натрия), он приобретает заполненную внешнюю оболочку из восьми электронов: Между полученными частицами – анионом фтора и катионом натрия – будет действовать сила электростатического притяжения, связывающая их между собой. Это и называется ионной химической связью.
Одно из свойств ионных соединений – способность образовывать кристаллическую решетку, в узлах которой расположены положительные и отрицательные ионы. Типичный представитель вещества с ионной связью – всем известная поваренная соль. Ее формула – NaCl. Большинство ионных соединений легко разрушаются под внешним воздействием или в химических реакциях. На рисунке 23 представлена . модель кристаллической решетки хлорида натрия 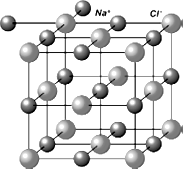 .
.
Молекулу поваренной соли можно представить в виде некоторого диполя, отрицательный и положительный заряд, которого
Рис. 23
пространственно разнесены и удалены друг от друга. Это полярная молекула.
Дата добавления: 2015-06-17; просмотров: 3344;
