Стехиометрия химических реакций
Для описания химических реакций, лежащих в основе промышленных химико-технологических процессов, используют основные законы химии – законы стехиометрии, химического равновесия, химической кинетики. В гл. 2 и 3 рассмотрены основные принципы использования законов химической термодинамики и химической кинетики в технологии. В этом параграфе кратко изложены основы использования законов стехиометрии.
Стехиометрия – это учение о соотношениях масс или объемов реагирующих веществ. В основе стехиометрии лежат законы Авогадро, Гей-Люссака, а также сохранения массы, эквивалентов, постоянства состава, кратных соотношений.
Соотношения, в которых вещества вступают в реакцию, называют стехиометрическими. Законы стехиометрии в химии могут быть использованы в расчетах, связанных с формулами веществ, а также с нахождением теоретически возможных масс получающихся продуктов реакции.
Стехиометрическое уравнение реакции отвечает законам сохранения. Оно может быть записано как в привычном виде (слева – реагенты, справа – продукты)
аА + bВ = rR + sS, (I)
так и в соответствии с алгебраическими правилами в виде
–аА – bВ + rR + sS = 0 (II)
или еще в более общем виде
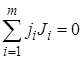 . (1.1)
. (1.1)
В такой записи знак стехиометрического коэффициента ji позволяет определить, является ли данное вещество реагентом (тогда стехиометрический коэффициент отрицателен: ji < 0) или продуктом реакции (тогда ji > 0).
Если реакция сложная и состоит из п независимых последовательных или параллельных стадий, то стехиометрия реакции может быть выражена системой из п уравнений типа уравнения (1.1):
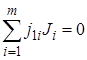 ;
;
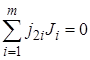 ; (1.2)
; (1.2)
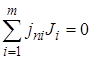 .
.
В соответствии с алгебраическими правилами каждое из этих уравнений может быть умножено на любую константу (кроме нуля) и смысл этих уравнений не изменится.
Если при стехиометрических расчетах количество вещества выражают в молях, то они сводятся к сравнительно простым стехиометрическим балансам. Например, если протекает реакция
2А + В  2R, (III)
2R, (III)
то в соответствии с законами стехиометрии всегда на каждые 2 моль вступившего в реакцию вещества А одновременно вступит в реакцию 1 моль вещества В и образуется 2 моль продукта R.
Если исходные количества участников реакции (I) составляют nA,0, nB,0 и nR,0,а текущие количества пА, пB и nR,то для любого момента времени будут справедливы как стехиометрические соотношения
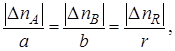
так и другие вытекающие из них соотношения, называемые стехиометрическими балансами,например
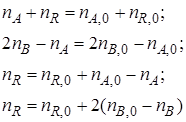
и др.
Следует иметь в виду, что для стехиометрических расчетов и составления стехиометрических балансов не имеет значения, является реакция обратимой или необратимой. Стехиометрический расчет ведется в предположении, что реакция может пройти до конца.
Стехиометрические балансы позволяют решить задачу о количестве независимых реакций в случае протекания сложных многостадийных реакций. При анализе механизма протекания таких реакций важно выделить независимые реакции, которые не могут быть получены простым алгебраическим суммированием двух или большего количества отдельных стадий.
Дата добавления: 2015-06-17; просмотров: 6358;
