Зависимость константы равновесия от температуры
Функциональная зависимость константы равновесия от температуры при постоянном давлении передается уравнением изобары Вант-Гоффа
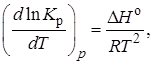 (2.9)
(2.9)
где ∆H° – изменение энтальпии при стандартном состоянии.
Из уравнения (2.9) следует, что при положительных значениях ∆H° (эндотермические реакции) 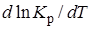 >0 и Кр(Т)– возрастающая функция. Если ∆H° < 0 (экзотермические реакции), то
>0 и Кр(Т)– возрастающая функция. Если ∆H° < 0 (экзотермические реакции), то 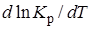 < 0 и константа равновесия уменьшается с повышением температуры. В обоих случаях равновесные концентрации участников реакции меняются, т. е. анализ уравнения показывает, что оно в количественной форме отражает вывод, вытекающий из принципа смещения равновесия: повышение температуры всегда смещает равновесие в направлении эндотермической реакции.
< 0 и константа равновесия уменьшается с повышением температуры. В обоих случаях равновесные концентрации участников реакции меняются, т. е. анализ уравнения показывает, что оно в количественной форме отражает вывод, вытекающий из принципа смещения равновесия: повышение температуры всегда смещает равновесие в направлении эндотермической реакции.
Для процессов, протекающих при постоянном объеме, зависимость константы равновесия от температуры передается уравнением изохоры Вант-Гоффа
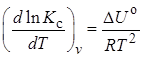 ,
,
где ∆U° – изменение внутренней энергии в стандартном состоянии.
Уравнения изобары и изохоры реакции определяют зависимость константы равновесия от температуры в дифференциальной форме. Для практических расчетов равновесия при различных температурах требуется провести интегрирование этих уравнений. Если ∆H° не зависит от температуры (это справедливо для узкого интервала температур), то из выражения (2.9) получаем
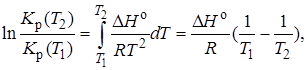
по которому, располагая данными о ∆Н° и Крдлякакой-либо одной температуры Т1 можно легко определить значение константы равновесия при другой температуре Т2.
Интегрируя уравнение (2.9) при условии независимости теплового эффекта от температуры, можно вынести ∆Н° из-под знака интеграла и получить следующее уравнение:
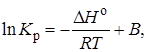
где В – постоянная интегрирования.
Так как согласно уравнению изотермы Вант-Гоффа
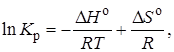
то В = ∆S°/R (при условии независимости ∆Н° и ∆S° от температуры).
Дата добавления: 2015-06-17; просмотров: 2295;
