Свободно-радикальное окисление
Под свободными радикалами понимают молекулу или ее часть, имеющую неспаренный электрон на молекулярной или на внешней атомной орбите. Появление неспаренного электрона – появление у молекулы свободной валентности. Свободные радикалы реакционноактивны и вступают в химические реакции для приобретения недостающего электрона. Полное восстановление О2 до Н2О требует присоединения 4 электронов: О2 + 4е- + 4Н+ ® 2Н2О.
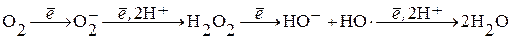
При неполном восстановлении (т.е. присоединении 1, 2 или 3е-) образуются свободно-радикальные формы кислорода: О2×` – супероксидный анион; НО× – гидроксильный радикал (RO∙ - алкоксильный радикал), ∙О2Н – супероксидный радикал.
К реактивным формам кислорода относят оксид азота (NO∙), пероксинитрит (ONOO-) и озон. По L.Flohe и H.Budde (2006) в клеточной биологии под свободными радикалами понимают малые высоко реактивные О-, N-, S- и C-центровые радикалы, которые участвуют в оксидативном или нитросативном стрессе. Нитросативный стресс характеризуется суперпродукцией NO∙, которая часто усугубляет эффекты избыточной продукции супероксидного аниона.
Супероксидный радикал может возникать в процессе биохимических реакций (окисление с помощью флавопротеинов, в цепях монооксигеназных реакций и др.).
Свободные радикалы инициируют цепные реакции. Если в реакцию вступают ненасыщенные жирные кислоты, то говорят о пероксидном окислении липидов (ПОЛ). Этот процесс важен для развития патологических состояний, связанных с повреждением мембран. Схема цепных реакций:
1. Инициация при действии R×, металлов, излучений: Х×+RH®R×+XH.
2. Удлинение, разветвление: R× + O2® ROO× (пероксидный радикал). ROO× + RH ® R× + ROOH (гидроперекись) и т.д.
3. Терминация (обрыв цепи): ROO× + R1× ® ROOR1; R× + R1×® RR1.
Применительно к фрагменту ненасыщенной жирной кислоты можно показать ранние, средние и поздние продукты перекисного окисления. Во всех полиненасыщенных жирных кислотах присутствует дивинилметановая структура, которая легко вступает в реакцию отрыва протона, сопровождающуюся образованием свободного радикала. Ранние продукты ПОЛ – диеновые конъюгаты; средние продукты ПОЛ – гидроперекиси; конечные продукты ПОЛ – малоновый диальдегид. Эти процессы лежат в основе повреждения мембран клеток. Перспективно определение в выдыхаемом воздухе этана, который выделяется при окислении w3-жирных кислот, например, a-линоленовой 18:3, D9,12,15, а также пентана – при окислении w6-жирных кислот, например, линолевой 18:2, D9,12 или арахидоновой 20:4, D5,8,11,14.
Свободнорадикальные процессы лежат в основе биохимических механизмов неспецифической резистентности организма, определяемой специальными клетками тканей и крови.
Типичным свободнорадикальным процессом является защитная функция фагоцитов. Свободнорадикальный процесс при окислительном стрессе начинается от НАДФН оксидазы – трансмембранного цитохром b содержащего флавопротеина (gp91)phox: НАДФН+О2→2∙О2¯ +НАДФ++ Н+ . Супероксидный анион является не очень агрессивным радикалом. Как слабое основание он ассоциируется в супероксидный радикал с рК 5. При низких значениях рН в вакуолях фагоцитов происходит спонтанная дисмутация: ∙О2Н + ∙О2¯ + Н+ → Н2О2 + О2 и ∙О2Н +∙О2Н → Н2О2 + О2 . При нейтральном значении рН для превращения супероксидного аниона требуется супероксиддисмутаза. Это завершение свободнорадикального процесса. Однако, образованная перекись водорода или гидропероксиды (ROOH) могут вновь образовать агрессивные гидроксильный или алкоксильный радикалы: Н2О2 → 2∙ОН и ROOH → ∙ОН + RО∙.
Возникает вопрос, сколько в клетке содержится О2×` ? Подсчитано, что в оптимальных условиях при 37 ºС клетки кишечной палочки (E.coli) поглощают примерно 6×106 молекул кислорода в секунду. Около 0,1% кислорода превращается в супероксидный анион. Клетка может аккумулировать 240 мкмоль/мин супероксидного аниона. 95% О2×` обезвреживается с помощью супероксиддисмутазы и 5% остается для взаимодействия с молекулами-мишенями (I.Fridovich, 2001).
В полиморфноядерных лейкоцитах при окислительном стрессе миелопероксидаза приводит к образованию гипохлорита: Н2О2 + Cl¯ → ОCl¯ + Н2О. Затем возможны превращения: Cl¯ + ОCl¯ + Н+ → Cl2 + ОН¯ и Cl2 → ∙Cl + ∙Cl. Эти молекулы оказывают бактерицидное действие. Кроме этого гипохлорит и перекись водорода могут генерировать синглетный кислород при ультрафиолетовом облучении, который способен окислять ненасыщенные жирные кислоты.
В макрофагах возможна синхронная продукция двух радикалов ∙О2¯ и NO∙, которые могут образовать пероксинитрит: ∙О2¯ + NO∙ → ONОO¯. Пероксинитрит, не являясь радикалом, участвует в бактерицидном эффекте. При закислении среды он может вновь создать агрессивные свободные радикалы: ONОO¯ → ∙ОН + ∙NO2.
Антиоксидантная защита - это сдерживание процессов свободно-радикального окисления осуществляется с помощью неферментативных и ферментативных механизмов. 1) Неферментативная защита включает: комплексоны, связывающие металлы (этилендиаминотетрауксусная кислота); в водной фазе – витамин С, ураты, ароматические амины, SH-соединения; в липидной фазе – жирорастворимые витамины А (b-каротин), Е, гормоны стероидной природы, тироксин. 2) Ферментативная защита включает фермент супероксиддисмутазу (в цитозоле, ядрах и лизосомах простетическая группа – Cu2+, Zn2+, в митохондриях и у бактерий – Mn2+) О2.× + О2.× + 2Н+ ® Н2О2 + О2. Перекись водорода обезвреживается в каталазной или пероксидазной (чаще глутатионпероксидазной) реакциях. Активатор реакции – Se. В продукты питания добавляют антиоксидантные добавки: b-каротин, a-токоферол, ВНА – бутиловый гидроксианизол, ВНТ – бутиловый гидрокситолуен. Для профилактики радиационных поражений используют комплексы витаминов А, Е, С и b-каротин, Е, С.
В заключение необходимо заметить, что многие отечественные биохимики предпочитают пользоваться латинскими сокращенными аббревиатурами соединений, участвующих в энергетическом обмене (NAD, FMN, FAD, ATP и др.).
Дата добавления: 2015-06-12; просмотров: 4762;
