Окислительное фосфорилирование
Синтез АТФ из АДФ и неорганического фосфата, сопряженный с переносом протонов и электронов по дыхательной цепи от субстратов к кислороду, называется окислительным фосфорилированием.
Для количественного выражения окислительного фосфорилирования введен коэффициент окислительного фосфорилирования, который представляет собой отношение числа молекул неорганического фосфата, перешедших в состав АТФ в процессе дыхания, на каждый поглощенный атом кислорода. Отношение Р/О для полной дыхательной цепи равно 3, для укороченной – 2.
Энергия окисления, достаточная для образования молекулы АТФ выделяется в ЦПЭ в следующих стадиях: 1) НАД - ФМН (НАДН-дегидрогеназа); 2) цит b - цит с (убихинол- цитохром с редуктаза); 3) цит а - 1/2 О2 (цитохром с-оксидаза). На этих стадиях изменения ОВП превышают 0,22 В, что достаточно для образования макроэргической связи АТФ (>30,2 кДж/моль). Уменьшение свободной энергии, сопровождающее перенос протонов и электронов на кислород в результате одного дегидрирования, составляет примерно 220 кДж/моль. При этом на синтез АТФ в полной дыхательной цепи может быть израсходовано 30,2×3=90,6 кДж/моль. Отсюда КПД ЦПЭ около 40%. Остальная энергия рассеивается в виде тепла (поддержание температуры тела).
Известны три основных гипотезы окислительного фосфорилирования.
1. Механохимическая, или конформационная (Грин, Бойер, 60-е гг. ХХ в.). В процессе переноса протонов и электронов изменяется Конформация белков-ферментов. Они переходят в новое богатое энергией состояние, а затем при возвращении в исходную конформацию отдают энергию для синтеза АТФ. Гипотеза частично подтверждена: Еокисл.→ Еконформ. сдвигов → ЕАТФ.
2. Гипотеза химического сопряжения (Липман, Слейтер, Ленинджер, 30-40-е гг. ХХ в.). В сопряжении дыхания и фосфорилирования участвуют сопрягающие вещества, например вещество Х. Вещество «Х» акцептирует протоны и электроны от первого фермента в пункте сопряжения, взаимодействует с Н3РО4. В момент отдачи протонов и электронов второму ферменту пункта сопряжения связь становится макроэргической. Далее макроэрг передается на АДФ с образованием АТФ. До настоящего времени не выделены сопрягающие вещества.
3. Хемиосмотическая гипотеза П.Митчелла (1961). По современным представлениям дыхание и фосфорилирование связаны между собой электрохимическим потенциалом (ЭХП) на внутренней мембране митохондрий. Для объяснения необходимы следующие понятия: а) внутренняя мембрана митохондрий непроницаема для Н+ и ОН-; б) во внутреннюю мембрану митохондрий вмонтирована АТФ-синтаза, катализирующая обратимую реакцию: АТФ + Н2О « АДФ + Рн. АТФ-синтаза состоит из следующих субъединиц: F0 – гидрофобный сегмент из 13 полипептидных цепей, связанный с внутренней мембраной митохондрий; F0 – это протонный канал, по которому в норме только могут перемещаться протоны через мембрану; F1 – сопрягающий фактор, катализирующий синтез АТФ при перемещении протонов. В укороченной цепи переноса электронов отсутствует только первый этап, остальной перенос электронов такой же, как и в полной цепи; в) синтез АТФ осуществляется при перемещении протонов через АТФ-синтазу в направлении от ММП (межмембранное пространство) к матриксу.
Суть окислительного фосфорилирования: за счет энергии переноса электронов в ЦПЭ (Еокисления) происходит движение протонов через мембрану в ММП и создается электрохимический потенциал (ЕЭХП). При возвращении протонов назад через АТФ-синтазу энергия ЭХП трансформируется в энергию АТФ – ЕАТФ. Итак: ЕОкисл. ® ЕЭХП ® ЕАТФ.
НАДН-КоQ редуктаза, цитохром редуктаза и цитохромоксидаза выталкивают протоны в межмембранное пространство. Протоны берутся из Н2О матрикса или за счет конформационных изменений в ферментах. Со стороны матрикса на мембране будет преобладать отрицательный заряд (избыток ОН-), а со стороны ММП положительный (за счет Н+). Возникает ЭХП, который состоит из двух компонентов: осмотического (разности концентраций ионов Н+) и электрического (разности электрических потенциалов):ΔmН+ = Dj + DрН. Эта величина измерена, она равна ~0,25 В (хемиосмотическая гипотеза П.Митчела). При обратном токе протонов через канал АТФ-синтазы (разрядка мембраны) возникает 3 молекулы АТФ в полной ЦПЭ и 2 молекулы АТФ в укороченной. Таким образом внутренняя мембрана митохондрий выполняет роль сопрягающей мембраны. Теперь можно суммировать все строение ЦПЭ в виде 5 ферментативных комплексов, привязав их положение к шкале ОВП (таблица 6.3).
Таблица 6.3
Компоненты митохондриальной цепи переноса протонов и электронов
| ОВП, В | Компоненты ЦПЭ |
| -0,4 | Субстраты 2 и 3 рода |
| -0,3 | Комплекс I (полная ЦПЭ) |
| НАДН-дегидрогеназа (КФ 1.6.5.3.). 700-800 кДа, 25-30 субъединиц, 1 ФМН, 2 Fe2S2, 4-5 Fe4S4 | |
| ~0 | Субстраты I рода |
| Комплекс II (укороченная ЦПЭ) | |
| Сукцинатдегидрогеназа (КФ 1.3.5.1.). 125 кДа, 4-6 субъединиц, 1 ФАД, 1 Fe2S2, 1Fe4S4, 1 Fe3S4, 2 убихинона, 1 гем цитохрома b | |
| Комплекс III (обе ЦПЭ) | |
| Убихинол-цитохром с-редуктаза (КФ 1.10.2.2.). Около 400 кДа, 11 субъединиц, 2 Fe2S2, 2 гема цитохрома b, 1 гем цитохрома с1 | |
| +0,3 | Комплекс IV (обе ЦПЭ) |
| Цитохром с-оксидаза (КФ 1.9.3.1.). Около 200 кДа, 8-13 субъединиц, 2 Cu, 1 Zn, 1 гем цитохрома а и 1 гем цитохрома а3 | |
| Комплекс V (обе ЦПЭ при сопряжении дыхания и фосфорилирования) | |
| Н+-транспортирующая АРФ-синтаза (КФ 3.6.1.34.). Больше 400 кДа, 8-14 субъединиц | |
| +0,8 | Кислород |
Полная ЦПЭ - 1,3,4 и 5 комплексы, укороченная ЦПЭ – 2,3,4 и 5 комплексы.
В англоязычной литературе указывается, что на каждую пару электронов, переносимых от НАДН в межмембранное пространство выталкивается 10 протонов, а при окислении сукцината – 6 протонов. В результате проведенных исследований установлено, что для синтеза 1 молекулы АТФ необходимо 4 протона, 3 из которых используется для образования АТФ, а 1 протон используется для транспорта Рн, АТФ и АДФ через митохондриальную мембрану. Следовательно, если 10 протонов выталкивается в межмембранное пространство, а 4 используется для синтеза АТФ, то коэффициент окислительного фосфорилирования равен 2,5 (10/4) в полной дыхательной цепи и 1,5 (6/4) в укороченной дыхательной цепи. Однако, окончательный вывод можно будет сделать только при полной расшифровке механизма функционирования АТФ-азы.
У некоторых морских бактерий возникновение электрохимического потенциала на мембране связано с возникновением ΔmNa, что определяет синтез АТФ, создание солевых градиентов и движение жгутиков.
Дыхательный контроль – это регуляция скорости переноса электронов по дыхательной цепи отношением АТФ/АДФ. Чем меньше это отношение (преобладает АДФ), тем интенсивнее идет дыхание (это обеспечивает реакцию АДФ + Рн ® АТФ). Это видно по увеличению потребления кислорода митохондриями после добавки АДФ (эксперименты Чанса) или по усиленному дыханию бегущего человека.
Вещества, прекращающие поток электронов по дыхательной цепи ферментов, называют ингибиторами дыхания. Ротенон и амитал специфически ингибируют перенос электронов в НАДН-дегидрогеназном комплексе и таким образом предотвращают генерирование протонного градиента в 1-м комплексе. В то же время указанные ингибиторы не нарушают окисление сукцината. Антимицин А тормозит ток электронов между цитохромами b и c1, предотвращая синтез АТФ, сопряженный с генерированием протонного градиента в 3-м комплексе. Этот блок можно обойти добавлением аскорбата, который непосредственно восстанавливает цитохром с. Наконец, ток электронов может быть блокирован между цитохромоксидазным комплексом и кислородом под действием CN-, N3- и СО. В присутствии этих ингибиторов из-за блокирования тока электронов не происходит фосфорилирования, сопряженного с генерированием протонного градиента в 4-м комплексе.
Разобщение дыхания и окислительного фосфорирования возникает при повышении проницаемости мембраны митохондрий для протонов в любом месте, а не только в канале АТФ-синтазы. При этом не создается электрохимический потенциал и энергия окисления рассеивается в виде тепла. Так действуют ионофоры (2,4-динитрофенол, валиномицин и др.). Они переносят обратно протоны через мембрану, выравнивая градиенты рН и мембранного потенциала. Лекарственные препараты (аминобарбитал), продукты жизнедеятельности микроорганизмов, избыток тиреоидных гормонов (вызывают накопление ненасыщенных жирных кислот, являющихся ионофорами) и др. приводят к разобщению дыхания и фосфорилирования, обеспечивая гипертермию.
На разобщении дыхания и фосфорилирования базируется терморегуляторная функция тканевого дыхания. Тканевое дыхание, протекающее в митохондриях и не сопровождающееся образованием макроэргов, называют свободным или нефосфорилирующим окислением.
Природным разобщающим агентом является термогенин, протонный канал в митохондриях бурых жировых клеток. Бурый жир обнаружен у новорожденных и животных, впадающих в зимнюю спячку и служит для теплообразования. При охлаждении организма норадреналин активирует гормонзависимую липазу. Благодаря активному липолизу в организме образуется большое количество свободных жирных кислот, которые распадаются в результате β-окисления и в дыхательной цепи. Так как жирные кислоты одновременно открывают протонный канал термогенина, их распад не зависит от наличия АДФ, т.е. протекает с максимальной скоростью и генерирует энергию в форме тепла.
Образованная в результате окислительного фосфорилирования в митохондриях АТФ обменивается на внемитохондриальную АДФ с помощью специальных белков транслоказ (транслоказы составляют до 6% от всех белков внутренней мембраны митохондрий).
Гипоэнергетические состояния возникают 1) при нарушении поступления субстратов для дегидрирования (на всех этапах от пищи до матрикса митохондрий); 2) при нарушении поступления О2 в митохондрии (на всех этапах от дыхания, связь с кислорода с гемоглобином, транспорт и пр.); 3) при нарушении мембран митохондрий, композиции липидного бислоя и ферментативных ансамблей внутренней мембраны митохондрий. Предложено вычислять энергетическое состояние клетки, вычисляя «заполнение» системы АТФ-АДФ-АМФ макроэргами. Если все три компонента представлены АТФ, то система энергетически полностью заполнена и ее энергетический заряд равен 1,0. Если же система представлена только АМФ, то ее энергетический заряд равен 0.
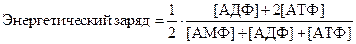
Энергетический заряд клетки является важной величиной, определяющей соотношение катаболических и анаболических процессов в ней. В тканях животных важную регуляторную роль выполняет величина отношения АТФ/АДФ.
В сутки человек потребляет в среднем 27 моль кислорода. Основное его количество (примерно 25 моль) используется в митохондриях в ЦПЭ. Следовательно, ежесуточно синтезируется 125 моль АТФ, или 62 кг (при расчете использован коэффициент Р/О = 2,5, т.е. среднее значение коэффициента фосфорилирования). Масса всей АТФ, содержащейся в организме, составляет примерно 20-30 г. Следовательно, каждая молекула АТФ за сутки 2500 раз проходит процесс гидролиза и синтеза.
Молекулярные моторы – это ферменты, трансформирующие химическую энергию гидролиза АТФ в механическую работу (Schliwa M., 2006). В эукариотических клетках выделяют три различных класса моторов: 1) миозин; 2) кинезин и 3) динеин. Для них характерны: 1) протяженная полярная структура, вдоль которой в одном направлении перемещаются актиновые филаменты (миозин) или микротрубочки (кинезины и динеины); 2) молекулярная организация взаимодействующих субъединиц должна обеспечивать однонаправленное движение; 3) связывающие центры для АТФ и подвижных элементов локализуются в глобулярных каталитических доменах, называемых головками; 3) энергию для движения получается при гидролизе АТФ и реализуется через конформационные изменения белков (поворот головки); 5) взаимодействие субъединиц молекулярных моторов обеспечивает перемещение структур в вязкой цитоплазме. В настоящее время известны 18 классов миозинов (мышцы и др. ткани), 10 семейств кинезинов (цитозоль клеток) и 2 группы динеинов (плазма крови). Три типа моторов различаются по молекулярной массе: кинезины – 45 кДа, миозины – 100 кДа и динеины – 500 кДа. По структуре близки кинезины и миозины. Молекулярные моторы используются различными живыми организмами для клеточной активности – контракция, транспорт органелл, подвижность клеток, клеточное деление, передача информации, процессы развития и др.
Дата добавления: 2015-06-12; просмотров: 6087;
