Окислительное дезаминирование
Значение окислительного дезаминирования состоит в выделении аммиака, который используется для синтеза мочевины, и образования α-кетокислот для различных метаболических процессов: глюконеогенеза, синтеза жирных кислот, заменимых аминокислот и окисления до углекислоты и воды с образованием энергии.
1. У животных и человека процесс локализован в пероксисомах клеток, главным образом, печени и почек.
2. Реакции дезаминирования катализируется ферментами L-иD-оксидазами.
3. L- и D-оксидазы являются флавопротеинами с простетическими группами ФМНиФАД, соответственно.
4. Оксидазы L-аминокислот активны при рН = 10ипри физиологических значениях рН (7,4) их активность в десять раз ниже (рис. 14.2). Поэтому прямого окислительного дезаминирования L-аминокислот в пероксисомах практически не происходит (за исключением L-лизина).
5. В тканях при физиологических значениях рН активны оксидазы D-аминокислот. Но в клетках млекопитающих нет D-аминокислот. Роль оксидаз D-аминокислот не понятна. Предполагают, что эти ферменты необходимы: 1) для обезвреживания D-аминокислот, случайно проникших во внутреннюю среду организма с микроорганизмами; 2) при развитии опухолей возможно появление D-аминокислот в тканях, а, следовательно, появление аномальных белков после включения D-аминокислот в первичную структуру синтезируемых белков.
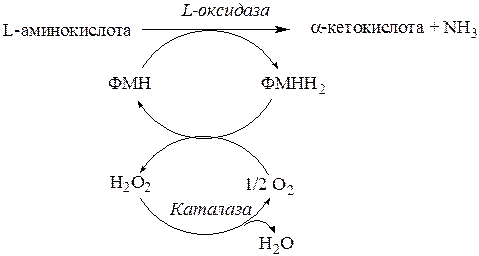
Рис. 11.2. Оксидаза L-аминокислот
В митохондриях клеток обнаружена высокоактивная оксидаза L-глутаминовой кислоты. Она имеет специальное наименование – глутаматдегидрогеназа (ГлДГ).
1. Коферментами этого фермента являются НАД+ и НАДФ+.
2. Реакция обратима и широко представлена в различных клетках.
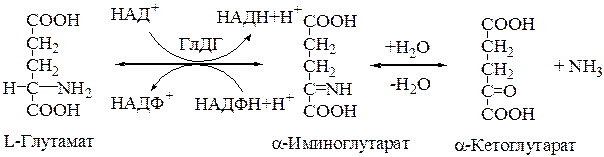
3.Фермент ГлДГ играет ключевую роль во взаимосвязи метаболизма аминокислот и общего пути катаболизма. Это олигомерный фермент с мол. Массой 312000 Да, состоящий из 6 субъединиц по 52000 Да каждая. Фермент активен в виде мультимера.
4. Активаторы – АДФ, ГДФ; ингибиторы – АТФ, ГТФ, НАДФвосстановленный, тироксин, эстрогены. В присутствии ингибиторов фермент подвергается химической модификации, т.е. диссоциирует на субъединицы и теряет основную активность (хотя может катализировать дезаминирование других аминокислот, например, аланина).
Процесс синтеза L-глутамата из a-кетоглутарата и аммиака называется восстановительным аминированием (кофермент чаще НАДФН).
Непрямое дезаминирование аминокислот открыто А.Е.Браунштейном и Т.Эйлером (другое название процесса - трансдезаминирование). Процесс идет в два этапа: 1) в результате реакций трансаминирования аминные группы собираются в составе глутаминовой кислоты; 2) глутамат поступает в митохондрии, где подвергается прямому дезаминированию в глутаматдегидрогеназной реакции:
Обратная последовательность реакций, при которой происходит синтез аминокислот из a-кетокислот (a-кетоглутарата) и аммиака был назван трансреаминированием.
Дата добавления: 2015-06-12; просмотров: 4816;
