Работа в термодинамике.
В механике работа A связана с перемещением x тела как целого под действием силы F
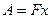 . (2.4)
. (2.4)
В термодинамике рассматривается перемещение частей тела. Например, если газ, находящийся в цилиндре под поршнем, расширяется, то, перемещая поршень, он производит над ним работу. При этом объем газа изменяется (рис. 2.1).
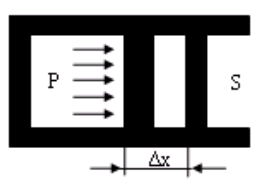
Рис. 2.1.
Рассчитаем работу, совершаемую газом при изменениях его объема. Элементарная работа при перемещении поршня на величину dx равна
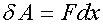 .
.
Сила связана с давлением соотношением
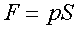 ,
,
где S - площадь поршня.
Изменение объема равно
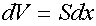 .
.
Таким образом
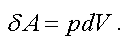 (2.5)
(2.5)
Полную работу A, совершаемую газом при изменениях его объема от V1 до V2, найдем интегрированием формулы (2.5)
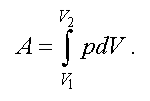 (2.6)
(2.6)
Выражение (2.6) справедливо при любых процессах
Вычислим работу при изопроцессах:
1) для изохорного процесса V1 = V2 = const, А = 0;
2) для изобарного процесса p = const, A = p(V2 – V1) = pΔV;
3) для изотермического процесса T = const. Из уравнения (1.6) следует, что
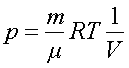 .
.
Выражение (2.6) будет иметь вид
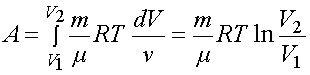 . (2.7)
. (2.7)
2.3. Количество теплоты
Процесс передачи энергии от одного тела к другому без совершения работы называют теплообменом.
Количество теплоты - это энергия, переданная телу в результате теплообмена. Для изменения температуры вещества массой m от Т1 до Т2 ему необходимо сообщить количество теплоты
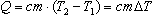 (2.8)
(2.8)
Коэффициент с в этой формуле называют удельной теплоемкостью: [с]=1 Дж/(кг∙К).
При нагревании тела Q > 0, при охлаждении Q < 0.
2.4. Первое начало термодинамики. Применение для изопроцессов.
Если система обменивается теплом с окружающими телами и совершает работу (положительную или отрицательную), то изменяется состояние системы, т.е. изменяются её макроскопические параметры. Так как внутренняя энергия U однозначно определяется макроскопическими параметрами, то отсюда следует, что процессы теплообмена и совершения работы сопровождаются изменением внутренней энергии системы.
Первый закон термодинамики является обобщением закона сохранения и превращения энергии для термодинамической системы. Он формулируется следующим образом:
Изменение внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты, переданной системе, и работой, совершенной системой над внешними телами.
ΔU = Q – A (2.9)
Соотношение, выражающее первый закон термодинамики, часто записывают в другой форме:
Дата добавления: 2015-06-10; просмотров: 1219;
