Как решаются проблемы теории
1. Абиогенный синтез нуклеотидов

Одна из проблем до недавнего времени состояла в том, что химикам не удавалось подобрать реалистичные условия, в которых из азотистых оснований, рибозы и фосфорной кислоты сами собой синтезировались бы рибонуклеотиды. И азотистые основания, и рибоза могут формироваться самопроизвольно из простейших ингредиентов в условиях, которые могли существовать на древней Земле или в протопланетном облаке. Но вот объединяться вместе, чтобы образовать рибонуклеотид, они в этих условиях отказываются. Точнее говоря, пуриновые нуклеотиды (аденозин А, гуанозин Г) синтезируются, но с низкой эффективностью, а пиримидиновые (уридин У, цитидин Ц) не синтезируются совсем. Кроме того, очень трудно получить рибозу и «правильные» азотистые основания в достаточно чистом виде. Обычно образуется чудовищная смесь всевозможных сахаров или азотистых соединений, в которой «нужные» вещества составляют лишь незначительный процент. В ходе дальнейших самопроизвольных реакций все эти вещества соединяются друг с другом тысячами разных способов, и обычно всё кончается образованием нерастворимых смол, из которых уже почти невозможно получить что-то путное.
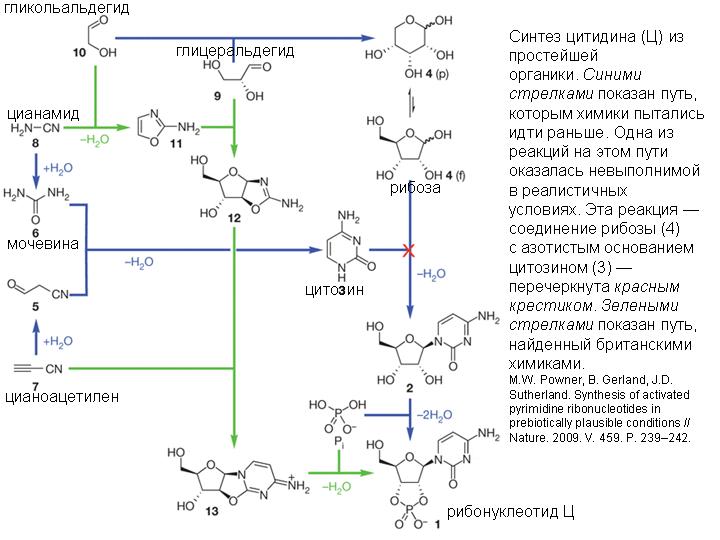
В 2009 г. химик Джон Сазерленд (John Sutherland) и его коллеги из Манчестерского университета (Великобритания) нашли замечательный «обходной путь», позволяющий синтезировать рибонуклеотиды не из готовых крупных блоков — рибозы и азотистых оснований — а из более простых органических молекул.
В основе их открытия лежат три замечательные находки.
Первая состоит в том, что они догадались сразу добавить в реакционную смесь фосфорную кислоту (неорганический фосфат). До сих пор все исходили из естественного допущения, что фосфат нужен только на последней стадии синтеза рибонуклеотида, когда фосфат присоединяется к рибозе, которая до этого уже присоединилась к азотистому основанию. Однако оказалось, что фосфат необходим и на ранних стадиях процесса. Его присутствие снижает выход разнообразных «ненужных» веществ в ходе реакций и повышает выход «нужных».
Вторая находка состоит в том, что исследователи с самого начала поместили в реакционную смесь и вещества, основанные на углероде и кислороде (простейшие углеводы), и азотистые соединения. До сих пор с этими двумя классами веществ работали по отдельности, пытаясь из первых синтезировать сахара, а из вторых — азотистые основания. Смешивать их в одну кучу с самого начала считалось бесперспективным, так как это резко повышает химическую «комбинаторику», то есть разнообразие получаемых продуктов, и без того слишком большое. Но фосфат резко снижает эту комбинаторику, и в результате из исходной смеси эффективно синтезируются в большом количестве ключевые промежуточные продукты, не являющиеся ни сахарами, ни азотистыми основаниями (на рисунке они обозначены числами 11 и 12).
Все вещества исходной смеси вполне могли существовать на ранней Земле. Кроме фосфата, в смесь входят простейшие азотистые соединения — цианоацетилен (7) и цианамид (8) и простейшие углеводы — гликольальдегид (10) и глицеральдегид (9). В присутствии фосфата вещества 8 и 10 с большой эффективностью соединяются и образуют вещество 11 (2-амино-оксазол). Следующая реакция (соединение веществ 11 и 9) обычно ведет к образованию множества побочных продуктов, однако присутствие фосфата снова оказывается спасительным, резко повышая выход «нужного» вещества 12 (арабинозо-амино-оксазолин).
На следующем этапе вещество 12 реагирует с цианоацетиленом (7). В обычном водном растворе эта реакция сопровождается временным повышением pH, в результате чего промежуточные продукты гидролизуются, цианоацетилен начинает реагировать с гидроксильными группами, и в итоге получается смесь «ненужных» продуктов, от которых нельзя проложить путь к рибонуклеотидам. Однако и в этом случае на помощь приходит фосфат: он играет роль буфера, в его присутствии pH не повышается, и «вредный» гидролиз резко замедляется. Более того, избыток цианоацетилена начинает реагировать не с гидроксильными группами «полезных» промежуточных продуктов, а с фосфатом, и в результате выход нужного вещества 13 (арабинозо-ангидронуклеозид) из практически никакого становится очень высоким. Таким образом, в данном случае фосфат выполняет сразу две полезные функции, выступая в роли стабилизатора кислотности и химического буфера.
Теперь до настоящего активированного рибонуклеотида, пригодного для синтеза РНК, остался один шаг. Вещество 13 нужно фосфорилировать, чтобы оно превратилось в активированный рибонуклеотид Ц (бета-рибоцитидин-2’,3’-циклофосфат; на рисунке это вещество обозначено номером 1).
Как выяснилось, для этого реакционную смесь нужно только немного подогреть («настало утро, вода в луже согрелась»), а всё необходимое в ней уже имеется. Роль ключевого катализатора реакции фосфорилирования берет на себя, как ни странно, мочевина (6), которая образуется сама собой из излишков цианамида, изначально присутствовавшего в смеси.
Открытый путь абиогенного синтеза цитидина поражает своим изяществом. Особенно впечатляет использование побочных продуктов, получающихся на предыдущих этапах пути, в качестве необходимых помощников на следующих этапах.
Но это еще не всё. Вместе с «правильным» нуклеотидом Ц в ходе последней реакции получается и ряд других, «неправильных» нуклеозидов и нуклеотидов, которые мешают дальнейшему синтезу «правильных» молекул РНК. Авторы стали искать способ избавиться от этих побочных продуктов. Кроме того, они надеялись получить из цитидина еще и второй пиримидиновый нуклеотид — уридин (У).
То, что они в итоге обнаружили, слегка похоже на чудо. Оказалось, что обе цели достигаются одной простой мерой — ультрафиолетовым облучением, которого, конечно, на древней Земле было вдоволь, поскольку озоновый слой отсутствовал. Под воздействием ультрафиолета все «лишние» нуклеотиды постепенно разрушаются, а цитидин остается, и часть его превращается в уридин. В отличие от всех остальных пиримидиновых нуклеотидов, Ц и У оказались устойчивы к ультрафиолету. Не правда ли, это очень похоже на четкий и простой ответ на вопрос о том, почему из всех возможных пиримидиновых нуклеотидов в состав РНК вошли именно Ц и У?
Две простые и «реалистичные» добавки – фосфат и ультрафиолет – сразу решают кучу проблем, и все получается правильно. + Ультрафиолет нужен и в «цинковом мире».

Авторы нашли принципиально новый подход к абиогенному синтезу нуклеотидов, решили одну из труднейших проблем в теории происхождения жизни и открыли широкий простор для дальнейших исследований.

Путь абиогенного синтеза нуклеотидов, открытый Сазерлендом и его коллегами, хорошо идет при температурах и pH, встречающихся в небольших водоемах. Если водоем иногда пересыхает, это ускоряет дело, т.к. достигаются высокие концентрации реагентов.
В письме своему другу Джозефу Хукеру Дарвин осторожно предположил, что жизнь могла зародиться из неживой материи в «маленьком теплом пруду со всеми видами аммония, солей фосфора, светом, теплом, электричеством и т. д.». Вполне возможно, что он и на этот раз оказался прав.
Однако он полагал, что эту догадку едва ли удастся проверить, потому что в наши дни любое самопроизвольно образовавшееся органическое вещество немедленно будет съедено и переварено живыми организмами — чего, конечно, не произошло бы в те времена, когда жизнь еще не зародилась.
Скептическое отношение к возможности разгадать тайну зарождения жизни сохранялось довольно долго. Еще лет 50 назад попытки разгадать тайну происхождения жизни считались уделом «престарелых ученых в конце их карьеры, когда они могут просто сидеть в кресле и рассуждать». Вспомним, как Н. В. Тимофеев-Ресовский ехидно отвечал на вопросы о происхождении жизни: «Я тогда маленький был, не помню, вы спросите лучше у академика Опарина, он знает».
(Насмешки начали сходить на нет после опытов Миллера).
2. Проблема рибозимов – РНК-полимераз

Ключевым компонентом РНК-мира предположительно были молекулы РНК с РНК-полимеразной активностью, то есть рибозимы, катализирующие репликацию молекул РНК. Без таких рибозимов в мире РНК была бы невозможна настоящая наследственность и дарвиновская эволюция. У современных живых организмов такие рибозимы не обнаружены: по-видимому, они давно вытеснены более эффективными белковыми ферментами-полимеразами. Поэтому для того, чтобы реконструировать ранние этапы зарождения жизни, а заодно и окончательно доказать возможность существования способного к дарвиновской эволюции мира РНК, очень важно получить такой рибозим искусственно.
Ученые бьются над этой задачей уже более 10 лет, применяя попеременно то метод искусственной эволюции (случайные мутации + отбор удачных вариантов), то сознательное проектирование. Оба метода сталкиваются с трудностями. Возможности «разумного дизайна» ограничены отсутствием надежных методов предсказания каталитических свойств рибозимов по их первичной структуре (последовательности нуклеотидов). Для эффективной «искусственной эволюции» нужно научиться каким-то образом выбирать из огромного множества слегка различающихся молекул ту, которая лучше всех справляется со своей задачей, в данном случае — с копированием молекул РНК. Это непросто, потому что те рибозимы-полимеразы, которые удалось получить на сегодняшний день, не могут размножать сами себя (в этом случае проблема отбора была бы решена: какого рибозима в пробирке окажется больше, тот и «победитель»). Речь пока идет только о копировании фрагментов других молекул РНК (матриц), причем не любых, а со строго определенной нуклеотидной последовательностью. Если просто поместить в пробирку миллион разных рибозимов, то как потом узнать, какой из них насинтезировал больше копий матрицы?

До недавних пор высшим достижением науки в области создания рибозимов-РНК-полимераз был рибозим R18.
Этот рибозим использует в качестве матрицы одноцепочечную молекулу РНК с заранее подготовленной «затравкой» (праймером). Праймер — это небольшой кусочек комплементарной цепи РНК, присоединенный к одному из концов матрицы. Рибозим R18 достраивает комплементарную цепь, начиная от праймера. Максимум, чего от него можно добиться, — это присоединения 15–20 комплементарных нуклеотидов. Иными словами, если повезет, он может скопировать фрагмент молекулы РНК (матрицы) длиной до 20 нуклеотидов. В большинстве случаев, впрочем, процесс репликации РНК прерывается раньше. У R18 есть еще один недостаток: он копирует далеко не любую матрицу, а только узкий круг нуклеотидных последовательностей. Эффективность работы R18 сильно зависит от нуклеотидной последовательности матрицы. Этим R18 радикально отличается от «настоящих», белковых полимераз, которые копируют любые матрицы с одинаковой эффективностью и которым совершенно всё равно, в какой последовательности расположены в матрице нуклеотиды.
Попытки радикально улучшить работу R18 до сих пор были безуспешны. Появились даже опасения, что R18 представляет собой «эволюционный тупик», что его в принципе нельзя усовершенствовать путем внесения небольших изменений и нужно искать что-то совсем другое. Надо сказать, что пространство для поиска невообразимо велико: рибозим R18 состоит из 189 нуклеотидов; общее число возможных молекул РНК такой длины равно 4189 ≈ 10114. Это на много порядков больше числа элементарных частиц во Вселенной. Перепробовать все эти варианты, разумеется, невозможно.
Новая работа американских молекулярных биологов, опубликованная в журнале Science в 2011 г, показала, что R18 всё-таки не является тупиком, и на его основе можно изготовить более эффективные РНК-полимеразы. Выяснить это позволила новая методика, благодаря которой удалось резко ускорить «искусственную эволюцию» рибозимов с полимеразной активностью. Суть методики в том, что ДНК-овые гены множества слегка различающихся рибозимов прикрепляют к крошечным магнитным шарикам, которые, в свою очередь, помещаются в водно-жировую эмульсию, так что каждый шарик со своим геном оказывается изолирован от остальных в маленькой водяной капле. В этой капле при помощи ферментов осуществляется транскрипция — синтезируется множество копий рибозима, после чего рибозимам дают возможность реплицировать РНК-матрицу. Затем следует еще несколько хитрых операций, в результате которых те шарики, на которых рибозимы поработали наиболее успешно, метятся флуоресцентными метками. Остается только извлечь ярко светящиеся шарики и выяснить (путем секвенирования прикрепленного к шарику гена), что за рибозим так хорошо справился со своей работой.
Эта замечательная методика (в сочетании с еще несколькими методологическими новшествами) позволила авторам перепробовать десятки миллионов модификаций исходного рибозима R18. Конечно, десятки миллионов — это исчезающе малая доля от устрашающего числа 10114. Тем не менее этого оказалось достаточно, чтобы найти варианты, справляющиеся с функцией РНК-полимеразы намного лучше, чем R18.
Отбор велся в двух направлениях. С одной стороны, отбирались рибозимы, способные наиболее эффективно копировать одну стандартную матрицу. Так был получен рибозим C19. Разобравшись в его структуре, авторы сумели внести в него дополнительные усовершенствования методом «разумного дизайна» и получили еще более эффективный рибозим tC19. После этого был проведен еще и отбор матриц: внося изменения в стандартную матрицу, авторы «вывели» такую ее модификацию, которую рибозим tC19 копирует наиболее эффективно. В результате удалось поставить рекорд: рибозим скопировал участок молекулы РНК длиной в 95 нуклеотидов. На сегодняшний день это самая длинная молекула РНК, синтезированная рибозимом из отдельных нуклеотидов.
В другой серии экспериментов авторам удалось, используя несколько разных матриц, вывести рибозим, полимеразная активность которого не так сильно зависит от нуклеотидной последовательности матрицы. Этот рибозим обозначили буквой Z.
После этого ученые объединили полезные новшества, характерные для рибозимов tC19 и Z, в одной молекуле, и создали свой шедевр — рибозим tC19Z. В этом рибозиме соединились высокая полимеразная активность рибозима tC19 с повышенной универсальностью (низкой зависимостью от матрицы) рибозима Z.

Рибозим tC19Z способен копировать широкий круг матриц, причем делает он это с меньшим числом ошибок, чем все выведенные ранее рибозимы-полимеразы. Исходный рибозим R18 делает в среднем 4,3 ошибок на 100 присоединенных нуклеотидов, tC19 работает точнее (2,7 неправильных или пропущенных нуклеотидов на сотню), tC19Z ошибается еще реже (0,88 ошибок на 100 нуклеотидов).
Чтобы продемонстрировать широкие возможности рибозима tC19Z, авторы успешно размножили с его помощью не специально созданную для этой цели и больше ни на что не годную матрицу, а настоящую функциональную молекулу РНК — другой рибозим, Mini-hammerhead. Этот рибозим состоит всего из 24 нуклеотидов, но обладает собственной каталитической функцией: он умеет разрезать РНК с определенной нуклеотидной последовательностью в одном строго определенном месте. Рибозим tC19Z успешно справился с копированием рибозима Mini-hammerhead. Тем самым впервые была продемонстрирована репликация функциональной молекулы РНК при помощи рибозима-полимеразы.
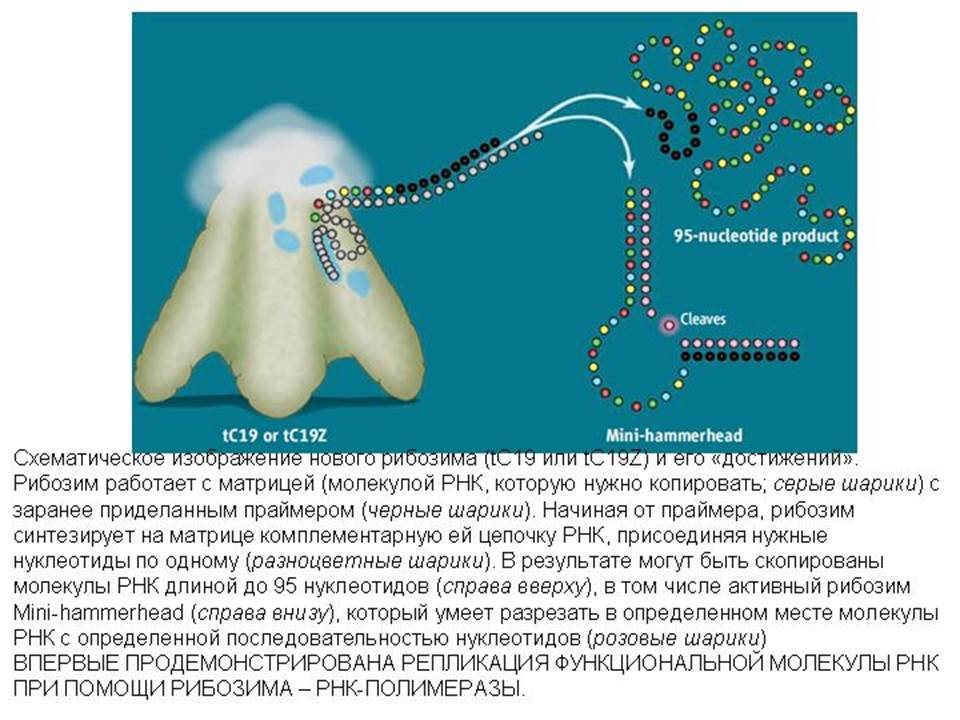
Полученные результаты — важный шаг на пути к созданию (или воссозданию?) полноценных рибозимов — РНК-полимераз, появление которых когда-то придало РНК-миру способность к дарвиновской эволюции.

Таким образом, уже известны рибозимы, которые могут размножать другие рибозимы небольшого размера. Но пока нет рибозимов, способных реплицировать самих себя. Впрочем, это и не обязательно! Могло быть разделение функций. Одни рибозимы могли реплицировать короткие фрагменты РНК, а другие рибозимы могли сшивать из них более крупные молекулы. Могла быть система поэтапной взаимной репликации. С рибозимами, способными скопировать короткие фрагменты РНК, мы уже познакомились. Известны также и рибозимы, сшивающие из коротких фрагментов крупные молекулы РНК.
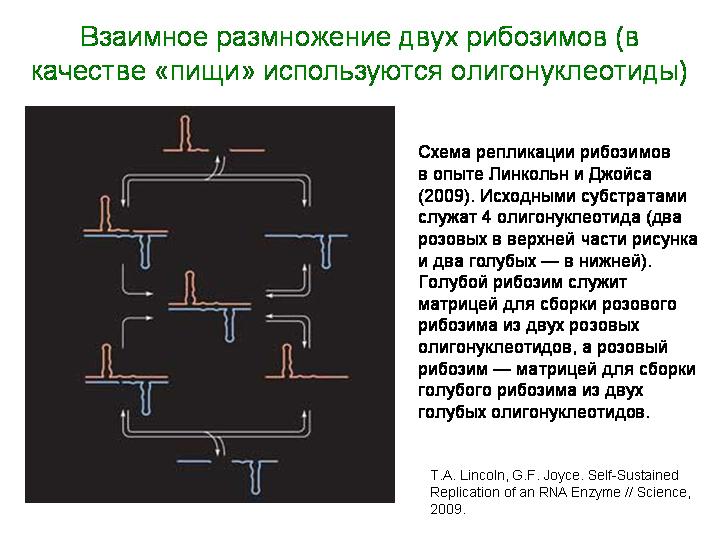
Трейси Линкольн и Джеральд Джойс из Скриппсовского института в Сан-Диего (Калифорния, США) в 2009 году сумели подобрать несколько пар рибозимов, которые размножают друг друга. В результате такой взаимной репликации популяция рибозимов может расти в геометрической прогрессии сколь угодно долго — для этого нужно только исправно снабжать растущую популяцию необходимыми «ресурсами», то есть исходными материалами для синтеза новых молекул РНК. За 30 часов популяция может в благоприятных условиях вырасти в 100 млн раз. Более того, заставив несколько разных пар размножающихся рибозимов конкурировать друг с другом за субстрат, исследователи вынудили их начать дарвиновскую эволюцию. В результате спонтанных мутаций и естественного отбора появились рекомбинантные рибозимы с повышенной скоростью размножения.
В отличие от прежних опытов, в которых удавалось добиться неограниченного размножения молекул РНК, в данном случае процесс идет без участия белковых ферментов. Единственная проблема – природа субстрата. Размножающиеся пары рибозимов не могут использовать в качестве исходного материала для сборки новых молекул РНК отдельные рибонуклеотиды: они умеют работать лишь с олигонуклеотидами, то есть с довольно длинными фрагментами РНК, состоящими из многих рибонуклеотидов.
Но ведь мы уже знаем, что рибозимы – РНК-полимеразы (tC19Z) в состоянии размножать короткие молекулы РНК!

Дата добавления: 2015-06-10; просмотров: 1133;
