РНК обзаводится помощниками
В дальнейшем РНК-организмы приобрели два важных усовершенствования. Первое состояло в том, что они научились синтезировать аминокислотные полимеры — сначала короткие пептиды, а затем и длинные белки. Эти вещества стали для РНК-организмов универсальными помощниками, справляющимися с большинством биологических «работ» гораздо лучше, чем рибозимы. (Второе усовершенствование - ДНК, она точнее копируется и стабильнее, чем РНК)
Откуда взялась у РНК-организмов способность синтезировать белки? Чтобы ответить на этот вопрос, мы должны поближе познакомиться с рибосомами — сложными молекулярными «машинками», при помощи которых синтезируют белки все современные живые клетки.
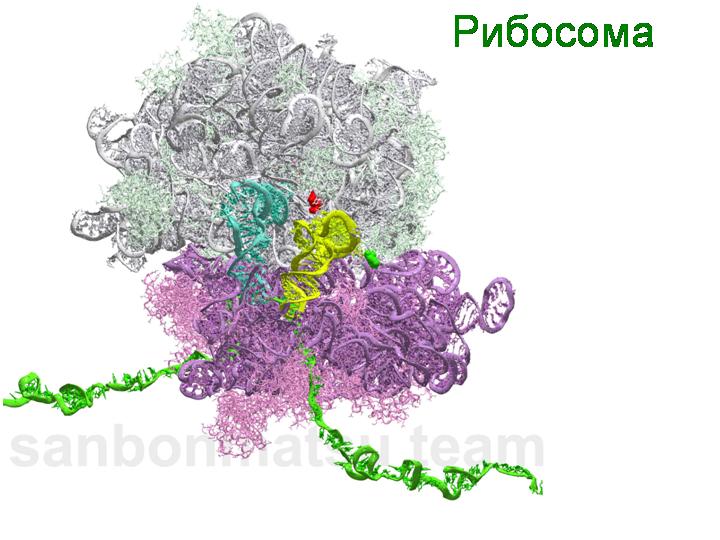
Рибосомы у всех живых существ — от бактерий до человека — устроены очень похоже. По-видимому, это означает, что рибосомы в их «современном» виде имелись уже у Луки. Рибосома состоит из двух частей, или субъединиц, — большой и малой. Основу обеих субъединиц составляют молекулы рибосомной РНК (рРНК). Снаружи к молекулам рРНК прилегают молекулы рибосомных белков.
До недавнего времени казалось, что загадка происхождения рибосом вряд ли будет разгадана. В не осталось никаких «переходных звеньев», то есть более простых молекулярных комплексов, которые могли бы претендовать на роль «предков» рибосом. Но в 2009 году канадские биохимики нашли ключик к этой тайне в самой структуре рибосом современных организмов.
Они сосредоточились на главной части рибосомы —молекуле РНК, которая называется 23S-рРНК и является основой большой субъединицы рибосомы. Эта молекула велика: состоит почти из 3000 нуклеотидов. В клетке она сворачивается в сложный трехмерный «клубок». Петли, выступы и другие элементы этого «клубка» обеспечивают выполнение разных функций: связь с рибосомными белками, присоединение малой субъединицы, присоединение и удержание в нужных позициях молекул тРНК, которые несут на своих «хвостиках» аминокислоты, необходимые для синтеза белка.
Рибосомные белки играют в рибосоме вспомогательную роль. Главные действия, необходимые для синтеза белка, осуществляются рибосомными РНК. Это значит, что изначально рибосомы могли состоять только из рРНК. Главный этап трансляции — присоединение аминокислот к синтезируемой белковой молекуле — осуществляется молекулой 23S-рРНК. Поэтому логично предположить, что все началось именно с этой молекулы.
Однако 23S-рРНК слишком велика и сложна, чтобы появиться в результате случайного комбинирования нуклеотидов. Ключевой вопрос в том, могла ли 23S-рРНК произойти от более простой молекулы-предшественницы в результате постепенной эволюции (путем последовательного добавления новых фрагментов). Удалось показать, что структура 23S-рРНК свидетельствует именно о таком ее происхождении.
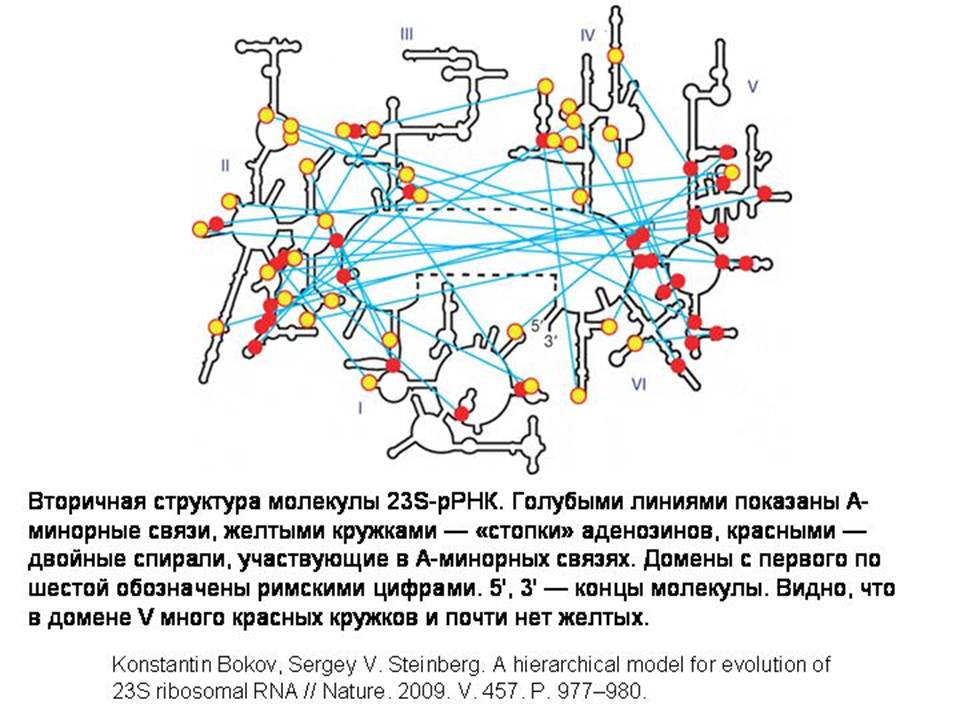
Целостность трехмерной структуры 23S-рРНК поддерживается связями между ее участками. Некоторые части молекулы сворачиваются в двойные спирали. К двойным спиралям «приклеиваются» другие участки, состоящие из нескольких идущих подряд аденозинов. Связи, возникающие между двойными спиралями и «стопками» аденозинов, необходимы для поддержания стабильной структуры той части молекулы, к которой принадлежит аденозиновая «стопка», но они не влияют на стабильность той ее части, к которой принадлежит двойная спираль. Если мы разорвем какую-то из этих связей, это нарушит структуру той части молекулы, где находится «стопка», но не причинит вреда той части, где расположена двойная спираль. Таким образом, если 23S-рРНК развивалась постепенно из простой молекулы-предшественницы, то сначала должны были появляться двойные спирали, и только потом к ним могли «пристраиваться» аденозиновые стопки.
Заметили, что в одной части молекулы имеется скопление двойных спиралей и почти нет аденозиновых стопок. Это наводит на мысль, что эволюция молекулы 23S-рРНК могла начаться именно с этого фрагмента молекулы.
Но если этот фрагмент был той «затравкой», с которой началась эволюция 23S-рРНК, то следует ожидать, что именно в нем находится какой-то важный функциональный центр молекулы. Так ли это? Оказывается, это действительно так: именно этот участок молекулы 23S-рРНК играет ключевую роль в присоединении аминокислот к синтезируемому белку (удерживает в правильных позициях «хвосты» двух молекул тРНК, обеспечивает сближение новой аминокислоты с предыдущей, и катализирует соединение аминокислоты с белком.
Обнаружив эти факты, исследователи перешли к более тонкому анализу структуры молекулы. Они подразделили ее на 60 блоков и проанализировали характер связей между ними. Фактически они рассматривали молекулу как сложный трехмерный «пазл» и пытались выяснить, поддается ли он сборке и разборке без поломки деталей. Оказалось, что молекулу действительно можно постепенно «разобрать», ни разу не нарушив структуру остающихся блоков. Можно отделять блоки один за другим, не нарушая ничего в оставшейся части. После этого остается «неразобранным» лишь маленький фрагмент молекулы, составляющий 7% от ее массы. Это тот самый каталитический центр, ответственный за удерживание двух молекул тРНК и присоединение аминокислот к белку.
Возможность последовательной разборки молекулы без повреждения остающихся частей — факт нетривиальный. Вряд ли это случайность. По-видимому, структура связей между блоками молекулы отражает последовательность добавления этих блоков в ходе эволюции молекулы.
Получается, что исходной функциональной молекулой — «проторибосомой», с которой началась эволюция рибосомы, — был каталитический центр молекулы 23S-рРНК, ответственный за соединение аминокислот.
Методом искусственной эволюции были получены рибозимы, способные катализировать соединение аминокислот, прикрепленных к тРНК, в короткие белковые молекулы. Структура этих искусственно выведенных рибозимов очень близка к структуре той проторибосомы, которую «вычислили» канадские биохимики на основе изучения структуры 23S-рРНК.
По-видимому, проторибосома была рибозимом, катализирующим синтез небольших белковых молекул в РНК-организме. Специфичность синтеза поначалу была низкой (аминокислоты выбирались более или менее случайно). В дальнейшем к проторибосоме добавлялись новые блоки, причем добавлялись они так, чтобы не нарушить структуру активного центра молекулы, а также всех тех блоков, которые присоединились ранее. Если очередная мутация приводила к нарушению уже сложившихся структур, она отсеивалась отбором.
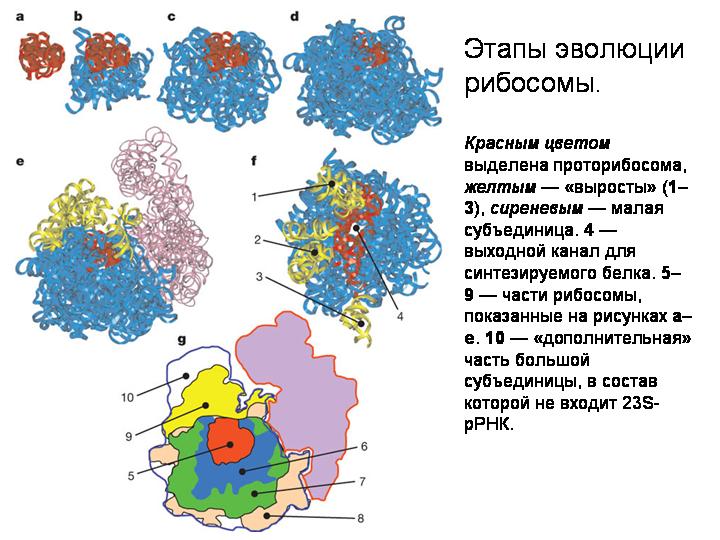
Реконструкция постепенной эволюции 23S-рРНК. Блоки добавлялись последовательно, повышая стабильность и эффективность работы проторибосомы. В итоге проторибосома оказалась окружена другими блоками со всех сторон за исключением канала для выхода образующейся белковой молекулы.
Таким образом, 23S-рРНК, при всей ее кажущейся сложности, построена на основе простого принципа. Ее блочная структура свидетельствует о том, что она могла быстро развиться в ходе эволюции из проторибосомы под действием мутаций и отбора.
Часть 7. Палеонтология (лекции 21-25)
Дата добавления: 2015-06-10; просмотров: 885;
