Уравнение состояния идеального газа. Опытные газовые законы.
В МКТ используют идеализированную модель идеального газа.
Идеальный газ - это газ, молекулы которого можно рассматривать как материальные точки, а их взаимодействие носит характер абсолютно упругого удара. (при низком р и высокой Т реальные газы приближаются к идеальным).
Состояние некоторой массы газа определяется тремя термодинамическими параметрами: р,V,T.
Давление газа представляет собой результат ударов молекул газа о стенки сосуда, в котором газ находится.
[р]=1Па, [V]= 1м3.
В соответствии с решением XI Генеральной конференции по мерам и весам (1960 г.) применяют две температурные шкалы - термодинамическую (Кельвина) и Международную практическую (Цельсия).
За 0°С принята температура замерзания воды при р=1 атм. За 0 К принята температура, при которой должно прекратиться хаотическое движение молекул. Анализ различных процессов показывает, что 0 К недостижим, хотя приближение к нему сколь угодно близко возможно.
Градус Кельвина равен градусу Цельсия.
Т= t°С+ 273, DT=Dt°.
Между параметрами газа существует определенная связь, называемая уравнением состояния. Уравнение, связывающее параметры состояния идеального газа, называется уравнением состояния идеального газа или уравнением Клапейрона:
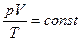 . (1)
. (1)
Для данной массы идеального газа отношение произведения давления на объем к абсолютной температуре есть величина постоянная.
Определим значение константы 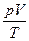 для определенного количества идеального газа, а именно для одного моля.
для определенного количества идеального газа, а именно для одного моля.
Согласно закону Авогадро 1 моль любого газа при нормальных условиях (Т0=273 К, р0=105 Па) имеет VМ= 22,4×10-3 м3.
Для одного моля
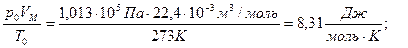
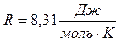 - молярная газовая постоянная.
- молярная газовая постоянная.
Для произвольной массы газа
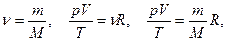
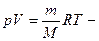 уравнение Менделеева-Клапейрона – уравнение состояния идеального газа произвольной массы.
уравнение Менделеева-Клапейрона – уравнение состояния идеального газа произвольной массы.
Уравнение (1) объединяет в себе три частных случая, три эмпирических закона для изопроцессов, т.е. процессов, при которых один из параметров остается постоянным.
1. Т= const – изотермический процесс,
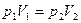 или
или 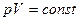 -
-
закон Бойля-Мариотта: 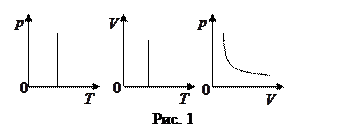 для данной массы идеального газа при Т= const произведение давления на объем есть величина постоянная.
для данной массы идеального газа при Т= const произведение давления на объем есть величина постоянная.
Графики зависимости между параметрами состояния газа при Т=const представлены на рис. 1.
2. 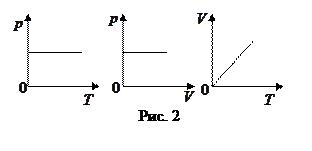 р= const – изобарный процесс,
р= const – изобарный процесс, 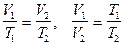 или
или 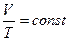
 -
-
закон Гей-Люссака: для данной массы идеального газа при р=const объем прямо пропорционален абсолютной температуре.
Графики зависимости между параметрами состояния газа при р=const представлены на рис. 2.
3.  V=const – изохорный процесс,
V=const – изохорный процесс, 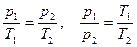 или
или 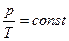 - закон Шарля: для данной массы идеального газа при V=const давление прямо пропорционально абсолютной температуре.
- закон Шарля: для данной массы идеального газа при V=const давление прямо пропорционально абсолютной температуре.
Графики зависимости между параметрами состояния газа при V=const представлены на рис. 3.
Дата добавления: 2015-06-10; просмотров: 632;
