Принцип Паули. Распределение электронов в атоме по состояниям
Если тождественные частицы имеют одинаковые квантовые числа, то их волновая функция симметрична относительно перестановки частиц. Отсюда следует, что два одинаковых фермиона, входящих в одну систему, не могут находиться в одинаковых состояниях, так как для фермионов волновая функция должна быть антисимметричной. Обобщая опытные данные, В. Паули сформулировал принцип, согласно которому системы фермионов встречаются в природе только в состояниях, описываемых антисимметричными волновыми функциями (квантово-механическая формулировка принципа Паули).
Из этого положения вытекает более простая формулировка принципа Паули, которая и была введена им в квантовую теорию (1925) еще до построения квантовой механики: в системе одинаковых фермионов любые два из них не могут одновременно находиться в одном и том же состоянии. Отметим, что число однотипных бозонов, находящихся в одном и том же состоянии, не лимитируется.
Напомним, что состояние электрона в атоме однозначно определяется набором четырех квантовых чисел:
главного n(n =1, 2, 3, ...),
орбитального l (l = 0, 1, 2, ..., n-1),
магнитного ml (ml = - l, .... - 1, 0, +1, ..., + l),
магнитного спинового (ms = + 1/2, - 1/2).
Распределение электронов в атоме подчиняется принципу Паули, который может быть использован в его простейшей формулировке: в одном и том же атоме не может быть более одного электрона с одинаковым набором четырех квантовых чисел n, l, ml и ms,т. е.
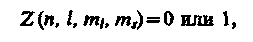
где Z (n, l, ml, ms)- число электронов, находящихся в квантовом состоянии, описываемом набором четырех квантовых чисел: n, l, ml, ms.Таким образом, принцип Паули утверждает, что два электрона, связанные в одном и том же атоме, различаются значениями по крайней мере одного квантового числа.
Согласно формуле (223.8), данному nсоответствует n2 различных состояний, отличающихся значениями l и ml. Квантовое число m, может принимать лишь два значения (± 1/2).
Поэтому максимальное число электронов, находящихся в состояниях, определяемых данным главным квантовым числом, равно
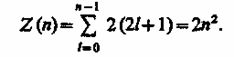
Совокупность электронов в многоэлектронном атоме, имеющих одно и то же главное квантовое число n, называют электронной оболочкой. В каждой из оболочек электроны распределяются по подоболочкам, соответствующим данному l. Поскольку .орбитальное квантовое число принимает значения от 0 до n - 1, число подоболочек равно порядковому номеру nоболочки. Количество электронов в подоболочке определяется магнитным и магнитным спиновым квантовыми числами: максимальное число электронов в подоболочке с данным l равно 2(2l + 1). Обозначения оболочек, а также распределение электронов по оболочкам и подоболочкам представлены в табл. 6.
Таблица 6
| Главное квантовое число л | |||||||||||||||
| Символ оболочки | К | L | M | N | О | ||||||||||
| Максимальное число электронов в оболочке | |||||||||||||||
| Орбитальное квантовое число l | |||||||||||||||
| Символ подоболочки | 1s | 2s | 2р | 3s | 3р | 3d | 4s | 4р | 4d | 4f | 5s | 5p | 5d | 5f | 5g |
| Максимальное число электронов в подоболочке |
Дата добавления: 2015-06-10; просмотров: 1184;
