Точкові дефекти в домішкових системах.
Домішковими системами вважаються кристали, в яких знаходяться сторонні структурні елементи. Подібні системи часто називають твердими розчинами. Їх є два типи: заміщення; втілення. Це коли сторонній структурний елемент займає, відповідно, вузлове положення замість матричного, або коли він розміщується в міжвузловинному положенні:.
У загальному випадку тверді розчини можна розглядати, як деякі узагальнення не стехіометричних систем.
1.6.1. Гетеротипні тверді розчини.
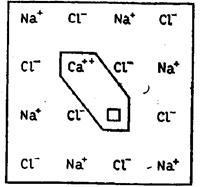
Типовим прикладом гетеротипних розчинів є змішані кристали NaCl та СaCl2. . У таких твердих розчинах солей однакові аніони, а катіони належать до речовин з різною валентністю. Очевидно, що тут число надлишкових катіонних вакансій іонів хлору повинно бути рівне числу іонів Ca++. Між катіонною вакансією ƒ 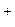 , яка має надлишковий негативний заряд, і катіоном Ca
, яка має надлишковий негативний заряд, і катіоном Ca 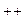 виникають як електричні сили взаємодії, так і сили взаємодії і за рахунок пружних спотворень гратки.
виникають як електричні сили взаємодії, так і сили взаємодії і за рахунок пружних спотворень гратки.
Об’єднання іновалентних іонів і катіонних вакансій в комплекси має назву точкових диполів (рис.1.7а).
Наявність у кристалах точкових диполів зумовлює аномально високу рухливість катіонів, і, відповідно, високу іонну провідність.
Утворення диполів із іновалентних іонів та вакансій грають виключно важливу роль у процесах пластичних деформацій іонних кристалів.
1.6.2. З”єднання з контрольованою валентністю.
У деяких випадках у склад кристалу можуть входити елементи, що володіють змінною валентністю, наприклад Fe (Fe++, Fe+++), Ni (Ni++, Ni+++) та інш. В цьому випадку введенням у гратку домішкових іонів певного типу можна контролювати число іонів, які відхиляються від своєї нормальної валентності. Зокрема, введенням у кристали NiO певної кількості Li2O можна регулювати число іонів Ni+++ без одночасного утворення вакантних вузлів в катіонній підгратці. Дефектний центр у таких кристалах представляє собою домішковий катіон Li+, розміщений у катіонному вузлі із більш низьким, по відношенню до матриці, зарядом і зв’язаний з сусіднім катіонним вузлом матриці, зайнятому іоном Ni+++ (рис.1.7б).
Склад отриманої речовини можна записати:
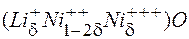
 а)
а) 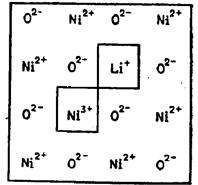 б)
б)
Рис.1.7. а) Диполі, що виникають в іонних кристалах з іновалентними домішковими іонами; б) кристал окису нікелю із домішкою літію.
Кристал NiO стехіометричного складу має блідо-зелене забарвлення і не є провідником. При добавленні 10 атомних % Li отримаємо речовину чорного кольору, яка має р -типу провідність.
Контрольні питання
1. Які тверді розчини називаються аномальними? Навести приклади.
2. Які тверді розчини солей називають гетеротипними?
3. Яким чином можна контролювати валентність у металах? Приклад.
§ 1.7. Термодинаміка точкових дефектів.
Дата добавления: 2015-06-10; просмотров: 655;
