Химия простых белков
Протамины и гистоны
Данная группа белков отличается рядом характерных физико-химических свойств, своеобразием аминокислотного состава и представлена в основном балками с небольшой молекулярной массой.
Протамины обладают выраженными основными свойствами, обусловленными наличием в их составе от 60 до 85% аргинина. Так, сальмин, выделенный из молок семги, состоит на 85% из аргинина. Высоким содержанием аргинина отличается другой хорошо изученный белок – клупеин, выделенный из молок сельди: из 30 аминокислот в нем на долю аргинина приходится 21 остаток. Расшифрована первичная структура крупеина.
Протамины хорошо растворимы в воде, изоэлектрическая точка их водных растворов находится в щелочной среде. По современным представлениям, протамины, скорее всего, являются пептидами, а не белками, поскольку их молекулярная масса не превышает 5000. Они составляют белковый компонент в структуре ряда сложных белков.
Гистонытакже являются белками основного характера. В их состав входят лизин и аргинин, содержание которых, не превышает 20-30%. Молекулярная масса гистонов намного больше нижнего предела молекулярной массы белков. Эти белки сосредоточены в основном в ядрах клеток в составе дезоксирибонуклеопротеинов и играют важную роль в регуляции экспрессии генов.
Проламины и глютеины
Это белки растительного происхождения, отличаются своеобразием аминокислотного состава и физико-химических свойств. Они содержатся в основном в семенах злаков (пшеница, рожь, ячмень и т.д.), составляя основную массу клейковины. Характерной особенностью проламинов является растворимость в 60-80% водном растворе этанола, в то время как все остальные простые белки в этих условиях обычно выпадают в осадок.
Наиболее изучены оризенин (белок из риса), глютеин и глиадин (из пшеницы), зеин (из кукурузы), гордеин (из ячменя).
Установлено, что проламины содержат 20-25% глютаминовой кислоты и 10-15% пролина.
Альбумины и глобулины
Эти белки относятся к белкам, широко распространенным в органвх и тканях животных. Наиболее богатыми ими белки сыворотки крови, молока, яичный белок, мышцы и др. В плазме крови человека в норме содержится около 7% белков, представленных преимущественно альбуминами и глобулинами.
Альбумины и глобулины – это глобулярные белки, различающиеся по растворимости.
Необходимо отметить, что само определение «альбумины» и «глобулины» основано на их растворимости в дистиллированной воде и полунасыщенном растворе (NH4)2SO4. Однако глобулины растворимы только в разбавленных солевых растворах.
Склеропротеины
Это фибриллярные белки, составляющие основу соединительной ткани животных и человека (коллаген, кератин, эластин и др.).
2 - Сложные белки(протеиды): липопротеиды, гликопротеиды нуклеопротеиды, фосфопротеиды, металлопротеиды, хромопротеиды.
Данные белки(протеиды) – содержат в своем составе небелковый компонент – простетическую группу.
По небелковому компоненту протеиды классифицируются на:
1) Липопротеиды– белки, содержащие липиды (хилимикроны, ЛВП, ЛНП, ЛОНП) – основная функция которых – транспорт липидов в организме.
2) Гликопротеиды– белки связанные с углеводами. Как правило эти белки являются мембранными белками, ответственными за иммунитет, группы крови,молекулярное распознавание, свертывание крови.
3) Нуклеопротеиды – белки связанные с нуклеиновыми кислотами. Например, в хромосомах ДНК намотана вокруг белков гистонов, вирусы также можно считать нуклеопротеинами.
4) Фосфопротеиды – белки, содержащие остатки фосфорной кислоты.
Примером служат: казеиноген молока, вителлин желтков яиц, ихтулин (белок икры рыб).
5) Металлопротеиды- это белки, связанные с ионами металловю
Например, белок ферритин, необходим для хранения железа. Многие металлопротеины являются ферментами, например, алкогольдегидрогеназа, окисляющая спирт, содержит ион цинка.
6) Хромопротеиды– белки, связанные с окрашенными соединениями (хромос – греч. – цвет). К таким белкам относятся – гемоглобин – белок, переносящий кислород в крови, миоглобин- белок, запасающий кислород в мышцах.
Классификация протеидов является условной.
Например, гемоглобин можно отнести и к хромопротеинам, и к металлопротеинам, а казеиноген молока – к фосфопротеинам и металлопротеинам (т.к. содержит ионы кальция).
Однако очень многие белки, кроме полипептидных цепей, содержат в своём составе небелковую часть, присоединённую к белку слабыми или ковалентными связями. Небелковая часть может быть представлена ионами металлов, какими-либо органическими молекулами с низкой или высокой молекулярной массой. Такие белки называют "сложные белки".Прочно связанная с белком небелковая часть носит название простетической группы.
Простетическая группа может быть представлена веществами разной природы. Например, белки, соединённые с гемом, носят название гемопротеины. В состав гемопротеинов, кроме уже рассмотренных выше белков гемоглобинов и миоглобина, входят ферменты - цитохромы, каталаза и пероксидаза. Гем, присоединённый к разным белковым структурам, выполняет в них характерные для каждого из белков функции (например, в составе гемоглобина переносит О2, а в составе цитохромов - электроны).
Белки, соединённые с остатком фосфорной кислоты, называют фосфопротеинами. Фосфорные остатки присоединяются сложноэфирной связью к гидроксильным группам серина, треонина или тирозина при участии ферментов, называемых протеинкиназами.
В состав белков часто входят углеводные остатки, придающие белкам дополнительную специфичность и часто уменьшающие скорость их ферментативного протеолиза. Такие белки носят название гликопротеинов. Многие белки крови, а также рецепторные белки клеточной поверхности относят к гликопротеинам.
Белки, функционирующие в комплексе с липидами, называют липопротеинами, а в комплексе с металлами - металлопротеинами.
Сложный белок, состоящий из белковой части (апопротеин)и небелковой части (простетическая группа), называют "холопротеин".
На рисунке представлена трехмерная схема жидкостно-мозаичной модели мембраны Сингера - Николсона на которойизображены глобулярные интегральные белки, погруженные в липидный бислой. Часть белков является ионными каналами, другие (гликопротеины) содержат олигосахаридные боковые цепи, участвующие в узнавании клетками друг друга и в межклеточной. Молекулы холестерола вплотную примыкают к фосфолипидным головкам и фиксируют прилегающие участки "хвостов". Внутренние участки хвостов молекулы фосфолипидов не ограничены в своем движении и ответственны за текучесть мембраны (Bretscher, 1985).
Мембрана имеет толщину 8-12 нм и состоит из бимолекулярного слоя липидов, причем гидрофобные концы молекул фосфолипидов и триглицеридов направлены внутрь, а наружу - гидрофильные головки. В двойной слой липидов встроены белки, которые пронизывают липидный слой насквозь, либо погружены в него частично. Существуют периферийные белки, покрывающие некоторые мембраны с одной или двух сторон сетью вытянутых молекул.
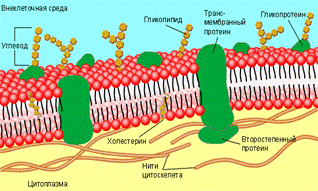
Рисунок - 1 — гликолипид, 2 — ионный канал, 3 — фосфолипид, 4 — интегральный белок, 5 — олигосахаридная боковая цепь, б — гидрофобный участок α—спирали, 7 — α—спиральная белковая молекула, 8 — холестерин, 9 — наружная поверхность, 10 — липидная сердцевина, 11 — внутренняя поверхность.
При этом молекулы фосфолипидов и белков находятся в непрерывном движении и взаимодействии. Липидный слой определяет основные структурные особенности биологических мембран, а белки ответственны за большинство функций мембран (транспорт, передача сигналов и т.д.). В активном состоянии мембрана имеет жидкую консистенцию, которая зависит от соотношения насыщенных и ненасыщенных жирных кислот.
В настоящее время выявлено четыре основных механизма транспорта через цитоплазматическую мембрану как клетки, так и клеточных органелл: диффузия, осмос, активный транспорт, экзо- и эндоцитоз.
Мембранные белки локализованына поверхности мембраны или могут быть внедрены на различную глубину в гидрофобную зону. Некоторые белки пронизывают мембрану насквозь, и различные гидрофильные группы одного и того же белка обнаруживаются по обе стороны клеточной мембраны. Белки, обнаруженные в плазматической мембране, играют очень важную роль: они участвуют в образовании ионных каналов, играют роль мембранных насосов и переносчиков различных веществ, а также могут выполнять рецепторную функцию.
Дата добавления: 2015-06-05; просмотров: 3260;
