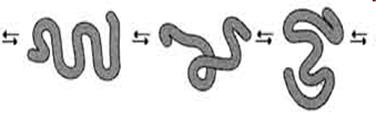
Случайные конформации молекулы эластина
Строение и функция эластина
В отличие от коллагена, образующего прочные фибриллы, способные выдержать большие нагрузки, эластин (также белок межклеточного матрикса) обладает резиноподобными свойствами. Нити эластина, содержащиеся в тканях лёгких, в стенках сосудов, в эластичных связках, могут быть растянуты в несколько раз по сравнению с их обычной длиной, но после снятия нагрузки они возвращаются к свёрнутой конформации.
Эластин содержит в составе около 800 аминокислотных остатков, среди которых преобладают аминокислоты с неполярными радикалами, такие как глицин, валин, аланин. Эластин содержит довольно много пролина и лизина, но лишь немного гидроксипролина; полностью отсутствует гидроксилизин.
Наличие большого количества гидрофобных радикалов препятствует созданию стабильной глобулы, в результате полипептидные цепи эластина не формируют регулярные вторичную и третичную структуры, а принимают в межклеточном матриксе разные конформации с примерно равной свободной энергией (рис.). Это как раз тот случай строения первичной структуры, когда отсутствие одной стабильной упорядоченной конформации приводит к возникновению необходимых белку свойств.
ΙΙ Классификация белков по химическому строению
 1 - Простые белки(протеины): альбумины, глобулины, протамины, гистоны, проламины, глютеины, склеропротеин.
1 - Простые белки(протеины): альбумины, глобулины, протамины, гистоны, проламины, глютеины, склеропротеин.
Они содержат в своём составе только полипептидные цепи, состоящие из аминокислотных остатков. Их называют "простые белки".Примером простых белков могут служить основные белки хроматина - гистоны; в их составе содержится много аминокислотных остатков лизина и аргинина, радикалы которых имеют положительный заряд. Рассмотренный выше белок межклеточного матрикса эластин также относят к простым белкам.
Простые белки в свою очередь делятся на основе некоторых критериев (растворимость, состав) на ряд подгрупп: альбумины, глобулины, протамины, гистоны, проламины, глютеины, склеропротеины.
Дата добавления: 2015-06-05; просмотров: 1361;
