УРОВНИ СТРУКТУРНОЙ ОРГАНИЗАЦИИ БЕЛКОВ
Как уже было сказано, белки представляют собой полипептиды, в молекулу которых входит от пятидесяти до нескольких тысяч аминокислот с относительной молекулярной массой свыше 10 000.
СТРУКТУРА БЕЛКОВ
Какова же структура белка?
Каждому белку в определенной среде свойственна особая пространственная структура. При характеристике пространственной (трехмерной) структуры выделяют четыре уровня организации молекул белков.
Первичная структура— последовательность аминокислот в полипептидной цепи. Такая структура специфична для каждого белка и определяется генетической информацией, т. е. зависит от последовательности нуклеотидов в участке молекулы ДНК, кодирующем данный белок. От первичной структуры зависят все свойства и функции белков. Замена одной-единственной аминокислоты в составе молекул белка или нарушение порядка в их расположении обычно влечет за собой изменение функции белка.
Постулаты (принципы формирования пептидной связи), сформулированные Л. Поллингом и Р. Кори:
1) атомы, образующие пептидную связь, копланарны (расположены в одной плоскости); вращение атомов или групп атомов вокруг пептидной связи невозможно;
2) принцип эквивалентности вклада АК-остатков в образование пептидной связи и, тем самым, в образование полипептидной цепи (исключение пролин);
3) принцип максимума водородных связей.
Первичную структуру белка стабилизируют (поддерживают):
пептидные связи (между АК-остатками);
дисульфидные связи (между свободными –SH-группами цистеина).
Первичная структура белка несет информацию о его пространственной структуре.
Первичная структура— ковалентно связанные мономеры в полимер.
| Лиз-глу-тре-ала-ала-ала-лиз-фен-глу-арг-глн-гиc-мет-асп-сер-сер-тре-сер-ала-ала-сер-сер сер-асн-тир-цис-асн-глу-мет-мет-лиз-сер-арг-асн-лей-тре-лиз-асп-арг-цис-лиз-про-вал-асн-тре-фен-вал-гис-глу-сер-лей-ала-асп-вал-глн-ала-вал-цис-сер-глн-лиз-асн-вал-ала-цис-лиз-асн-гли-глн-тре-асн-цис-три-глн-сер-три-сер-тре-мет-сер-иле-тре-асп-цис-арг-глу-тре-гли-сер-сер-лиэ-тир-про-асн-цис-ала-тир-лиэ- тре-тре-глн-ала-асн-лиз-гис-иле-иле-вал-ала-цис-глу-гли-асн-про-тир-вал-про-вал-гис-фен-асп-ала-сер-вал |
Рисунок - Аминокислотная последовательность белка рибонуклеазы (124 аминокислотных звена)
В живых клетках молекулы белков или отдельные их участки представляют собой не вытянутую цепь, а скручены в спираль, напоминающую растянутую пружину (это так называемая а-спираль), или сложены в складчатый слой (р-слой).
Такие α-спирали и р-слои являются вторичной структурой.
Вторичная структура белка —локальная конформация, обусловленная вращением отдельных участков полипептидной цепи вокруг одинарных ковалентных связей. Она возникает в результате образования водородных связей внутри одной полипептидной цепи (спиральная конфигурация) или между двумя полипептидными цепями (складчатые слои).
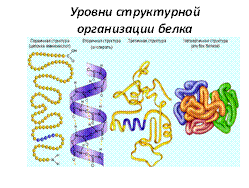
Вторичная структура—полипептидная цепь закручена в виде спирали, локальные упорядоченные структуры полимера - полностью α-спиральную конфигурацию имеет белок кератин. Это структурный белок волос, ногтей, когтей, клюва, перьев и рогов; он входит в состав наружного слоя кожи позвоночных.
Третичная структура белка —это расположение в пространстве всей полипептидной цепи, отдельные участки которой имеют собственную локальную конформацию.
Третичная структура белка –-миоглобина - полная укладка в пространстве одной цепи полимера .
Поддержанию третичной структуры белка способствуют гидрофобные связи, которые образуются внутри молекулы. В образовании этих связей принимают участие неполярные радикалы аминокислот. Могут также образовываться другие нековалентные связи.
У большинства белков спиральные и неспиральные участки полипептидной цепи складываются в трехмерное образование шаровидной формы — глобулу (характерна для глобулярных белков). Глобула определенной конфигурации является третичной структурой белка. Такая структура стабилизируется ионными, водородными, ковалентными дисульфидными связями (образуются между атомами серы, входящими в состав цистеина, цистина и мегионина), а также гидрофобными взаимодействиями. Наиболее важными в возникновении третичной структуры являются гидрофобные взаимодействия; белок при этом свертывается таким образом, что его гидрофобные боковые цепи скрыты внутри молекулы, т. е. защищены от соприкосновения с водой, а гидрофильные боковые цепи, наоборот, выставлены наружу.
Четвертичная структураформируется при объединении нескольких полипептидных цепей, имеющих третичную структуру. Образованный таким образом белок обладает новой функцией.
Четвертичная структура — гемоглобина – укладка субъединиц в пространстве.
Белки с четвертичной структурой называются олигомерными, а составляющие их индивидуальные полипептидные цепи — протомерами или мономерами. Такие соединения стабилизируются водородными связями и электростатическими взаимодействиями между АК-остатками, расположенными на поверхности протомеров.
Преимущества белков с четвертичной структурой:
1) экономия генетического материала;
2) уменьшение числа ошибок при синтезе белка;
3) качественное разнообразие белков — появление у белков новых функций.
Многие белки с особо сложным строением состоят из нескольких полипептидных цепей (субъединиц), образуя четвертичную структуру белковой молекулы. Такая структура имеется, например, у глобулярного белка гемоглобина. Его молекула состоит из четырех отдельных полипептидных субъединиц (протомеров), находящихся в третичной структуре, и небелковой части — гема.
Только в такой структуре гемоглобин способен выполнять свою транспортную функцию.
Дата добавления: 2015-06-05; просмотров: 4521;
