Вільна енергія, внутрішня енергія системи, кількість теплоти і робота.
Вн́утрішня ене́ргія тіла (позначається як E або U) — повна енергія термодинамічної системи за винятком її кінетичної енергії як цілого і потенціальної енергії тіла в полі зовнішніх сил. Внутрішня енергія складається з кінетичної енергії хаотичного руху молекул, потенціальної енергії взаємодії між ними і внутрішньомолекулярної енергії.
Внутрішня енергія є однозначною функцією рівноважного стану системи. Це означає, що кожний раз, коли система опиняється в даному рівноважному стані, її внутрішня енергія приймає властиве цьому стану значення, незалежно від передісторії системи. Отже, зміна внутрішньої енергії при переході з одного стану в інший буде завжди дорівнювати різниці значень в цих станах, незалежно від шляху, по якому здійснювався перехід. Внутрішню енергію тіла не можна виміряти напряму. Можна визначити тільки зміну внутрішньої енергії:
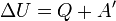 ,
,
де 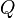 — кількість теплоти, передана термодинамічній системі,
— кількість теплоти, передана термодинамічній системі, 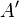 — робота, виконана над термодинамічною системою[1] або:
— робота, виконана над термодинамічною системою[1] або:
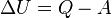 ,
,
де 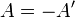 , робота виконана термодинамічною системою.
, робота виконана термодинамічною системою.
Оскільки внутрішня енергія є функцією стану, то її можна визначити як термодинамічний потенціал, залежний від об'єму, числа частинок у системі, та ентропії: U(V,S,N).
Для квазістатичних процесів виконується співвідношення:
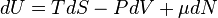
де T — температура, S — ентропія, P — тиск, μ — хімічний потенціал, N — кількість частинок в системі.
В рамках молекулярно-кінетичної теорії внутрішня енергія одноатомного ідеального газу визначається формулою
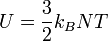 ,
,
де 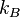 — стала Больцмана. Вона є середньою кінетичною енергією атома, помноженою на кількість атомів[2].
— стала Больцмана. Вона є середньою кінетичною енергією атома, помноженою на кількість атомів[2].
Для одного моля газу
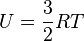 ,
,
де R — газова стала.
Ві́льна ене́ргія Гельмго́льца — термодинамічний потенціал, який визначає рівноважні термодинамічні характеристики системи в залежності від об'єму татемператури.
Рівноважний стан системи багатьох часток при визначеному об'ємі та сталій температурі визначається мінімумом вільної енергії.
Назва вільна енергія народилася в ті часи, коли створювалася теорія теплових машин. Дослідження показали, що нагрітий газ при охолодженні, що не роби, не віддає всю свою енергію. Ту частку енергії газу, яку можна було відібрати й перетворити в корисну роботу, стали називати вільною енергією.
Як і будь-яка інша енергія вільна енергія в класичній фізиці визначається з точністю до довільної сталої. Проте, виходячи із квантово-механічних уявлень, можна встановити природну точку відліку. При абсолютному нулі температури, вільна енергія збігається з енергією основного стану квантово-механічної системи.
Вільна енергія F визначається, як
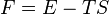 ,
,
де T — температура, S — ентропія, а E — внутрішня енергія системи.
Зміна вільної енергії дорівнює роботі, виконаній над тілом при ізотермічному процесі
Диференціал вільної енергії дорівнює
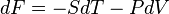 .
.
У випадку системи із змінним числом часток, диференціал вільної енергії отримує додатковий член
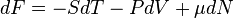 ,
,
де μ — хімічний потенціал, N — число часток.
Термодинамічні характеристики системи визначаються через похідні від вільної енергії. Наприклад, якщо потрібно визначити тиск у газі чи в рідині при певній температурі, можна скористатися формулою:
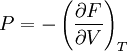 .
.
Аналогічно₴, якщо об'єм газу фіксований, то його ентропія визначається формулою
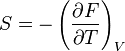 .
.
Якщо виділити якийсь об'єм у газі при умовах вільного обміну атомами із сусідніми об'ємами, то при сталій температурі його хімічний потенціал визначається, як похідна від вільної енергії по числу часток
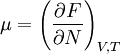
У статистичній фізиці найчастіше розглядається канонічний ансамбль Гібса, тобто набір одинакових за складом систем із визначеним об'ємом і при заданій темпаратурі — саме в тих умовах, для яких використовується вільна енергія.
Ймовірність pn реалізації стану n із енергією En в такому ансамблі визначається формулою
 .
.
Вільна енергія F знаходиться із умови нормування ймовірності.
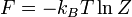 ,
,
де статистична сума Z дорівнює
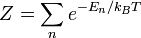
Для класичного ідеального одноатомного газу вільна енергія дорівнює
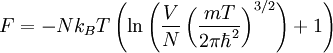
Дата добавления: 2015-06-01; просмотров: 2534;
