Теплоємність вільних електронів у металах та напівпровідниках.
3 Хімíчний потенціáл — один з термодинамічних параметрів системи; енергія додавання однієї частки в систему без здійснення роботи. Поняття хімічного потенціалу запровадив 1875 року Джозая Віллард Ґіббс.
Позначається зазвичай грецькою літерою 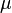 . Одиницею вимірювання хімічного потенціалу в системі СІ є Дж/моль.
. Одиницею вимірювання хімічного потенціалу в системі СІ є Дж/моль.
Фізична природа[ред. • ред. код]
Термодинамічні системи у багатьох випадках можуть обмінюватися атомами й молекулами із навколишнім середовищем. Окрім теплової рівноваги приведені в контакт термодинамічні системи намагаються встановити рівновагу за складом. Процеси встановлення рівноваги за складом повільніші за процеси встановлення рівноваги за температурою. Їхня швидкість залежить від природи речовини. Гази змішуються швидко, рідини повільніше, а дифузія у твердих тілах може зайняти багато років або тисячоліть.
Прагнення термодинамічних систем до встановлення рівноваги за складом кількісно характеризується величиною, яка називається хімічним потенціалом. Процеси встановлення рівноваги у термодинамічних системах відбуваються таким чином, щоб вирівняти хімічний потенціал у кожній області.
На перший погляд може здатися, що вирівнюються концентрації, але це справедливо лише для певного класу речовин і процесів. Існують системи, в яких закладена певна неоднорідність. Наприклад, густина повітря в земній атмосфері зменшується із висотою. Це зменшення зумовлене силами тяжіння. Тож концентрація молекул у повітрі неоднорідна. Сталим залишається хімічний потенціал, у якому врахована потенційна енергія молекул на різній висоті.
Для визначення хімічного потенціалу потрібно знайти різницю між енергією системи із N+1 часткою і системи із N частками. Хімічний потенціал - це енергія, на яку потрібно надати частці, щоб помістити її в термодинамічну систему. Важливо при цьому пам'ятати, що частка поміщається в систему таким чином, щоб перебувати в тепловій рівновазі з іншими частками.
Наприклад, частки ідеального газу не взаємодіють між собою, тож мінімальна енергія, необхідна для того, щоб вкинути один атом ідеального газу у систему із N атомів дорівнює нулю. Але для того, щоб цей новий атом перебував у тепловій рівновазі з іншими атомами, небхідно надати йому енергію, яка б дорівнювала середній кінетичній енергії інших атомів. Як наслідок цих міркувань, хімічний потенціал ідеального газу не дорівнює нулю.
У рівноважній гомогенній системі хімічний потенціал будь-якого з її компонентів у всіх точках однакові.
Зв'язок із іншими термодинамічними потенціалами[ред. • ред. код]
Визначення хімічного потенціалу через інші термодинамічні потенціали можна записати у вигляді:
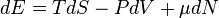
де Е — повна енергія системи, S — її ентропія, N — кількість частинок в системі.
Ця формула визначає, окрім хімічного потенціалу 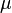 , також тиск P і температуру T.
, також тиск P і температуру T.
Можна довести, що хімічний потенціал задається формулою
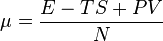
Якщо енергія системи залежить не від об'єму, а від інших термодинамічних параметрів 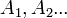 , початкова формула приймає вигляд
, початкова формула приймає вигляд
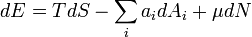
Багатокомпонентні системи[ред. • ред. код]
Якщо в системі є декілька різних типів частинок, є стільки ж різних хімічних потенціалів. Вони зазвичай позначаються різними індесками 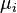 . Диференціал внутрішньої енергії записується:
. Диференціал внутрішньої енергії записується:
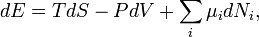
де 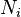 — кількість частинок і-го типу. Це співвідношенням можна також переписати через концентрації
— кількість частинок і-го типу. Це співвідношенням можна також переписати через концентрації
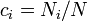 , де
, де 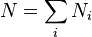 — сумарне число частинок в системі.
— сумарне число частинок в системі.
Якщо в термодинамічній системі може бути кілька фаз, то в умовах термодинамічної рівноваги кожен із типів хімічних потенціалів повинен бути однаковим для всіх фаз. Дана вимога призводить до правила фаз.
Дата добавления: 2015-06-01; просмотров: 861;
