РЕШЕНИЕ ЗАДАЧ
Задача 1. Найти удельную теплоемкость при постоянном объеме некоторого многоатомного газа, если известно, что плотность этого газа при нормальных условиях равна 0,795 кг/м3.
Дано: r = 0,795 кг/м3; р=1,013 .105Па; Т = 273К
Найти: Сv – ?
Решение: Удельная теплоемкость при постоянном объеме определяется формулой:
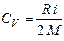
где, i – число степеней свободы, R – универсальная газовая постоянная, M – молярная масса газа.
Плотность идеального газа находим из уравнений Клапейрона-Менделеева 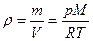
Получим 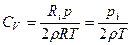
Число степеней свободы для многоатомного газа i=6
Вычислим 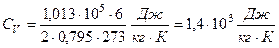
Задача 2.Какое количество теплоты поглощают 200г водорода, нагреваясь от 0 до 100 0С при постоянном давлении? Каков прирост внутренней энергии? Какую работу совершает газ?
Дано: m =0,2кг; M = 2 .10-3кг/моль; T1=273К; T2=373К
Найти: Q, ∆U, A – ?
Решение: Количество теплоты 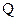 , поглощаемое газом при изобарическом процессе нагревании, определяется по формуле
, поглощаемое газом при изобарическом процессе нагревании, определяется по формуле 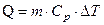
где m – масса нагреваемого газа; Ср – удельная теплоемкость газа при постоянном давлении; ∆T = (T1– T2) – изменение температуры газа.
Известно, что 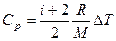
где i – число степеней свободы, для двухатомного газа i=5;
M – молярная масса; R – универсальная газовая постоянная
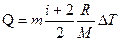
Вычислим 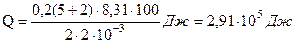
Внутренняя энергия газа определяется формулой
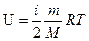
Изменение внутренней энергии равно
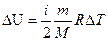
Подставим числовые значения 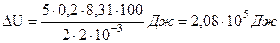
По первому началу термодинамики определяется работа, совершаемая газом 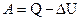
Найдем числовые значения 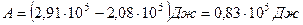
Задача 3.Используя функцию распределения молекул идеального газа по относительным скоростям 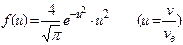 , определить число молекул, скорости v которых меньше 0,002 наиболее вероятной скорости, если в объеме газа содержится N=1,64 .1024 молекул.
, определить число молекул, скорости v которых меньше 0,002 наиболее вероятной скорости, если в объеме газа содержится N=1,64 .1024 молекул.
Дано: 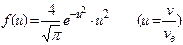 , vmax= 0,002. vВ; N=1,64 .1024
, vmax= 0,002. vВ; N=1,64 .1024
Найти: ∆N – ?
Решение: Число 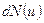 молекул, относительные скорости которых заключены в пределах от
молекул, относительные скорости которых заключены в пределах от 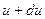
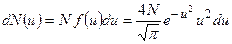 (1)
(1)
где N – число молекул в объеме газа.
По условиям задачи, vmax= 0,002 vВ , то 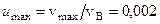 . Так как u<<1 то
. Так как u<<1 то 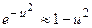 . Пренебрегая u2<<1, выражение (1) можно записать в виде
. Пренебрегая u2<<1, выражение (1) можно записать в виде
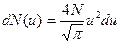 (2)
(2)
Проинтегрировав (2) по u в пределах от 0 до umax , найдем
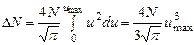
Вычислим 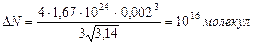
Задача 4. Определить во сколько раз отличается коэффициент диффузии азота (М1=28.10-3 кг/моль) и углекислого газа (М2=44.10-3 кг/моль), если оба газа находятся при одинаковых температуре и давлении. Эффективные диаметры этих газов считать одинаковыми.
Дано: М1=28 .10-3 кг/моль; М2=44 .10-3 кг/моль; Т1 = Т2; p1 = p2; d1 = d2
Найти: D1 / D2 – ?
Решение: Коэффициент диффузии газа 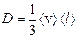 (1)
(1)
где 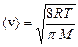 средняя арифметическая скорость его молекул;
средняя арифметическая скорость его молекул; 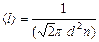 – средняя длина свободного пробега молекул. Поскольку
– средняя длина свободного пробега молекул. Поскольку 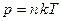 , из условия задачи (р1=р2, Т1=Т2), следует, что n1=n2. Подставив значения
, из условия задачи (р1=р2, Т1=Т2), следует, что n1=n2. Подставив значения 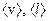 в формулу (1) и учитывая условия задачи, найдем
в формулу (1) и учитывая условия задачи, найдем 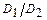 :
:
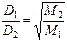 , вычисляем
, вычисляем 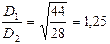
Дата добавления: 2015-05-30; просмотров: 916;
