Основы количественного определения активности ферментов. 1. Активность фермента выражается в скорости накопления продукта или скорости убыли субстрата в пересчете на количество материала
 1. Активность фермента выражается в скорости накопления продукта или скорости убыли субстрата в пересчете на количество материала, содержащего фермент.
1. Активность фермента выражается в скорости накопления продукта или скорости убыли субстрата в пересчете на количество материала, содержащего фермент.
Активность фермента может выражаться, например, в ммоль/с×л, г/час×л, МЕ/л, кат/мл и т.д.
2. Создание стандартных условий, чтобы можно было сравнивать результаты, полученные в разных лабораториях – оптимальная рН и фиксированная температура, например, 25°С или 37°С, соблюдение времени инкубации субстрата с ферментом.
3. Необходимо наличие избытка субстрата, чтобы работали все имеющиеся в растворе молекулы фермента.
За единицу активности любого фермента принимают такое его кол-во которое катализирует превращ-е 1мкм вещ-ва в 1 минуту. Активность ферментов опр-ют: пог скорости убыв субстрата; по скороти обр-я продукта. Удельная активность=мкм/мин.мг белка.
5. Понятие об активном центре фермента. Механизм действия ферментов. Ингибиторы ферментов: обратимые и необратимые, конкурентные. Применение ингибиторов в качестве лекарств.
Активный центр – комбинация аминокислотных остатков (обычно 12-16), обеспечивающая непосредственное связывание с молекулой субстрата и осуществляющая катализ. Аминокислотные радикалы в активном центре могут находиться в любом сочетании, при этом рядом располагаются АК, значительно удаленные друг от друга в линейной цепи, но сближенные в функциональной конформации. Наиболее часто в состав активного центра входят такие АК как серин, гистидин, трионин, цистеин.
Активный центр: -каталитический центр, -субстрат-связывающий участок, -кофермент-связывающий участок, - низкомолекулярное соединение, которое способствует взаимодействию субстрата и фермента.
Микросреда активного центра отличается от остального окружения фермента более низкой диэлектрической проницаемостью, приближающейся к таковой для некоторых органических растворителей. Также хар-ся повышенной микровязкостью, что ограничивает свободу вращательного движения группировок активного центра. Активный центр ограничивает влияние воды, что необходимо для эффективного катализа. При связывании субстрата и активного центра, субстрат претерпевает конформационные изменения (комплементарность увеличивается). – это явление индуцированного соответствия. В свою очередь в активном центре выделяют два участка:
1) якорный (контактный, связывающий) – отвечает за связывание и ориентацию субстрата в активном центре, 2) каталитический – непосредственно отвечает за осуществление реакции.
Известно, что для осуществления химической реакции необходимо, чтобы реагирующие вещества имели суммарную энергию выше, чем величина, называемая энергетическим барьером реакции. Для характеристики величины энергетического барьера Аррениус ввел понятие энергии активации. Энергия активации – это произведение энергии активации элементарного акта и постоянной Авогадро (Дж,/моль).
-Это энергетический барьер, который должны преодолеть молекулярные вещества по пути превращения в продукты реакции. Основная задача фермента – снизить Е активации.
Если фермент просто связывается с субстратом – этого не достаточно для катализа. Ф. не только распознает и связывает субстрат, но и индуцирует переходное состояние субстрата.
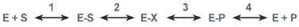 В ферментативной реакции можно выделить следующие этапы: 1. Присоединение субстрата (S) к ферменту (E) с образованием фермент-субстратного комплекса (E-S).
В ферментативной реакции можно выделить следующие этапы: 1. Присоединение субстрата (S) к ферменту (E) с образованием фермент-субстратного комплекса (E-S).
2. Преобразование фермент-субстратного комплекса в один или несколько переходных комплексов (E-X) за одну или несколько стадий.
3. Превращение переходного комплекса в комплекс фермент-продукт (E-P).
4. Отделение конечных продуктов от фермента.
Механизмы катализа: 1. Кислотно-основной катализ – в активном центре фермента находятся группы специфичных аминокислотных остатков, которые являются хорошими донорами или акцепторами протонов. Такие группы представляют собой мощные катализаторы многих органических реакций (Доноры -СООН -NH3+ -SH, Акцепторы -СОО- -NH2 -S-)
2. Ковалентный катализ – ферменты реагируют со своими субстратами, образуя при помощи ковалентных связей очень нестабильные фермент-субстратные комплексы, из которых в ходе внутримолекулярных перестроек образуются продукты реакции.
Типы ферментативных реакций: 1. Тип "пинг-понг" – фермент сначала взаимодействует с субстратом А, отбирая у него какие либо химические группы и превращая в соответствующий продукт. Затем к ферменту присоединяется субстрат В, получающий эти химические группы. Примером являются реакции переноса аминогрупп от аминокислот на кетокислоты - трансаминирование. 2. Тип последовательных реакций – к ферменту последовательно присоединяются субстраты А и В, образуя "тройной комплекс", после чего осуществляется катализ. Продукты реакции также последовательно отщепляются от фермента. 3. Тип случайных взаимодействий – субстраты А и В присоединяются к ферменту в любом порядке, неупорядоченно, и после катализа так же отщепляются.
Ингибитор - вещество, вызывающее специфичное снижение активности фермента. Т.о., неорганические к-ты и тяжелые Ме ингибиторами не являются, а являются инактиваторами, так как снижают активность любых ферментов, т.е. действуют неспецифично.
Можно выделить два основных направления ингибирования:
1. по прочности связывания Ф. с ингибитором ингибирование бывает обратимым и необратимым.
2. по отношению ингибитора к активному центру фермента ингибирование делят на конкурентное и неконкурентное.
При необратимом ингибировании происходит связывание или разрушение функциональных групп Ф., необходимых для проявления его каталитической активности (модификации подвергается активный центр). Бывают: а)Специфические (блокируют определенные группы активного центра: диизопропилфторфосфат прочно и необратимо связывается с гидроксигруппой серина в активном центре фермента ацетилхолинэстеразы, гидролизующей ацетилхолин в нервных синапсах. Ингибирование этого фермента предотвращает распад ацетилхолина в синаптической щели, в результате чего медиатор продолжает оказывать воздействие на свои рецепторы, что бесконтрольно усиливает холинергическую регуляцию); б) Неспецифические (реагирует с любыми свободными SН-группами белков. Не имеют физиологического значения и являются ферментными ядами: Присоединение ацетильной группы аспирина (ацетилсалициловой к-ты) к аминогруппе в активном центре фермента циклооксигеназы вызывает инактивацию последнего и прекращение синтеза простагландинов).
При обратимом ингибировании происходит непрочное связывание ингибитора с функциональными группами фермента слабыми нековалентными связями, вследствие чего активность фермента постепенно восстанавливается. Действует не долго. Пр.: прозерин, связывающийся с ферментом ацетилхолинэстеразой в ее активном центре. Группа ингибиторов холинэстеразы (прозерин, дистигмин, галантамин) используется при миастении, после энцефалита, менингита, травм ЦНС.
Конкурентный ингибитор по своей структуре похож на субстрат фермента. Поэтому он соперничает с субстратом за активный центр, что приводит к уменьшению связывания субстрата с ферментом и нарушению катализа. В этом состоит особенность конкурентного ингибирования – возможность усилить или ослабить ингибирование через изменение концентрации субстрата. Пр.: Конкурентное взаимодействие этанола и метанола за активный центр алкогольдегидрогеназы. Лекарства: ингибиторы холинэстеразы используют при лечении мышечных дистрофий. Увеличивают активность ацетилхолинэстеразы, конц-я ацетилхолина повышается, усиливается проведение нервного импульса (прозерин, эндрофомит). Антибактериальные средства сульфаниламиды, схожие по структуре с п-аминобензойной кислотой, компонентом фолиевой кислоты. При лечении сульфаниламидами в бактериальной клетке конкурентно нарушается использование п-аминобензойной кислоты для синтеза фолиевой кислоты, что и вызывает лечебный эффект.
Неконкурентное ингибирование связано с присоединением ингибитора не в активном центре, а в другом месте молекулы с образованием неактивного комплекса, что приводит к инактивации активного центра и снижению скорости реакции. Это может быть аллостерическое ингибирование, когда активность фермента снижается естественными модуляторами, или связывание с ферментом каких-либо токсинов.
Обратимо, но не может быть ослаблено или устранено повышением конц-ии субстрата. Пр.: синильная кислота (цианиды) связывается с гемовым железом ферментов дыхательной цепи и блокирует клеточное дыхание.
Дата добавления: 2015-05-26; просмотров: 1220;
